广州卿泽生物科技有限公司
6 年
手机商铺
- NaN
- 0.8999999999999999
- 1.9
- 0.8999999999999999
- 3.9
推荐产品
公司新闻/正文
【客户案例重温】RBIS如何通过调控核糖体合成驱动肺癌进展与化疗耐药
40 人阅读发布时间:2025-12-02 15:51
导读:
在肺癌治疗研究领域,靶向核糖体生物合成已成为一个新兴的前沿方向。我们合作客户在Journal of Translational Medicine上发表了一项重要研究,首次揭示了核糖体生物合成因子RBIS在肺腺癌(LUAD)中的致癌功能。

该研究成功运用Polysome Profiling等核心技术,直观证实了RBIS通过影响核糖体组装,进而调控全局蛋白质翻译效率,最终促进肿瘤生长并诱导化疗耐药。本文将深入解读这项研究,并展示Polysome Profiling技术如何在解决关键科学问题中发挥不可替代的作用。
文章索引:
标题:RBIS regulates ribosome biogenesis to affect progression in lung adenocarcinoma.
发表期刊:Journal of Translational Medicine
发表时间:2024.10
作者团队:复旦大学上海癌症中心癌症研究所 闫明霞研究员团队
IF:7.5/Q1
DOI:10.1186/s12967-024-05886-1.
研究结果
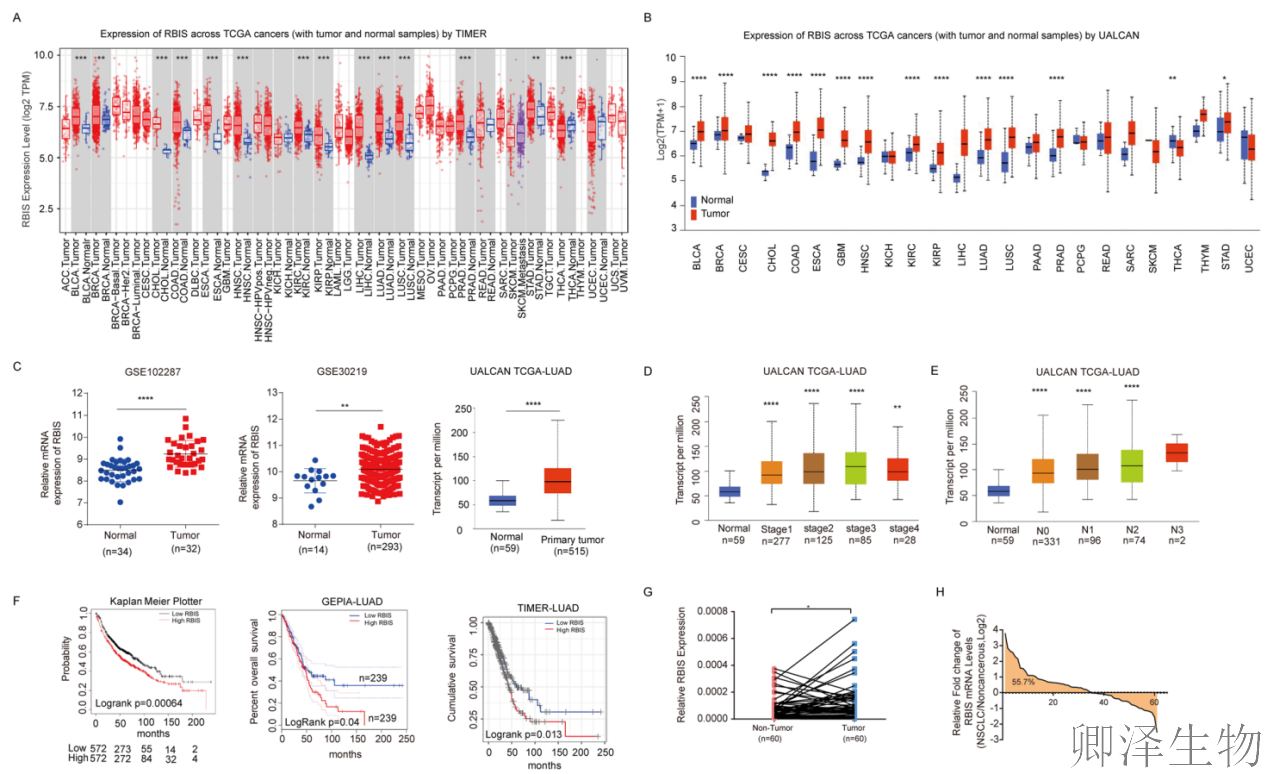
(1)RBIS在肺腺癌组织中过表达,并与不良预后相关
首先,作者通过多数据库和临床样本分析,系统验证了RBIS在肺腺癌中的表达特征和临床意义。
RBIS在肺腺癌组织中普遍高表达(图1A-C),且与患者不良预后显著相关(图1F),但与其临床分期或转移状态无直接关联(图1D-E),提示RBIS可能作为一种独立的致癌因子发挥作用。进一步通过60对临床样本验证,证实了RBIS在肿瘤组织中的上调(图1G-H),强化了其作为肺腺癌恶性表型驱动因子的可靠性。
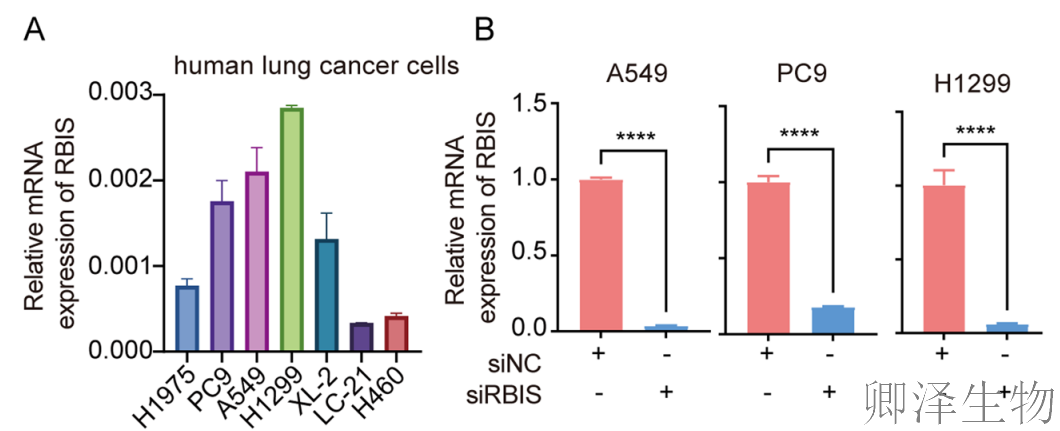
(2)敲低RBIS显著抑制肺腺癌细胞的迁移、侵袭潜能及体外生长
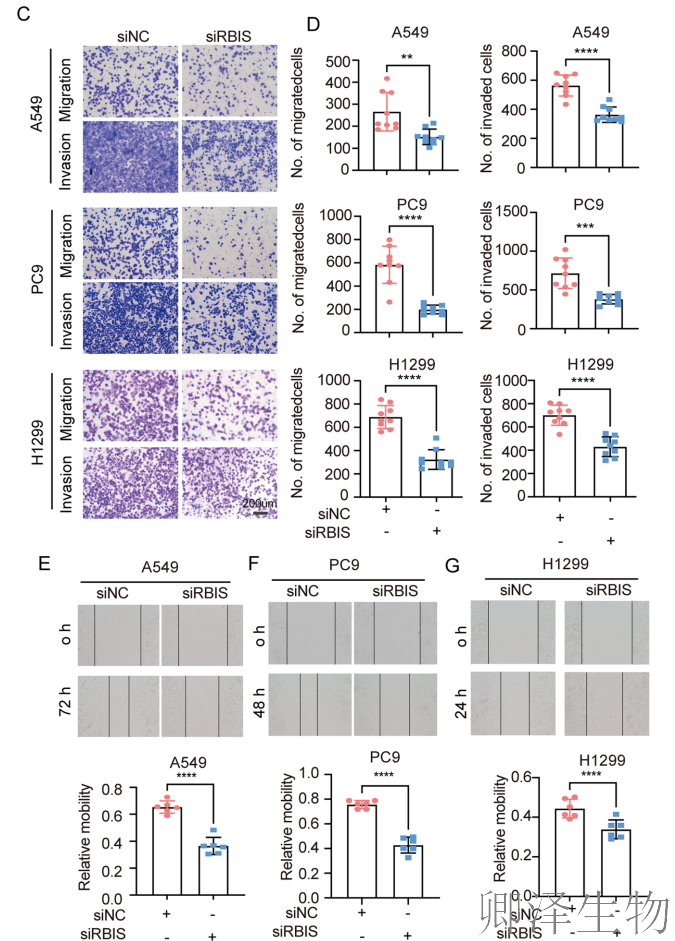
由于转移是肺癌患者死亡的主要原因,作者检测了敲低RBIS后肺腺癌细胞的体外迁移和侵袭潜力。
首先检测了RBIS在肺癌细胞系中的表达水平,并使用siRNA瞬时转染来抑制其在A549、H1299和PC9细胞中的表达(图2A, B)。Transwell实验表明,敲低RBIS显著抑制了肺癌细胞的体外迁移和侵袭潜力以及伤口愈合能力(图2C-G)。这些结果表明,RBIS可能是肺腺癌细胞转移特性的中介因子。
进一步评估RBIS是否影响肺腺癌细胞的体外生长。CCK-8实验的结果表明,在肺腺癌细胞中瞬时敲低RBIS导致细胞活力显著降低(图3A)。集落形成实验显示,敲低RBIS导致肺癌细胞集落形成减少(图3B)。CCK-8和集落形成实验的结果在RBIS稳定敲低细胞和瞬时敲低细胞之间是一致的(图3C-E)。
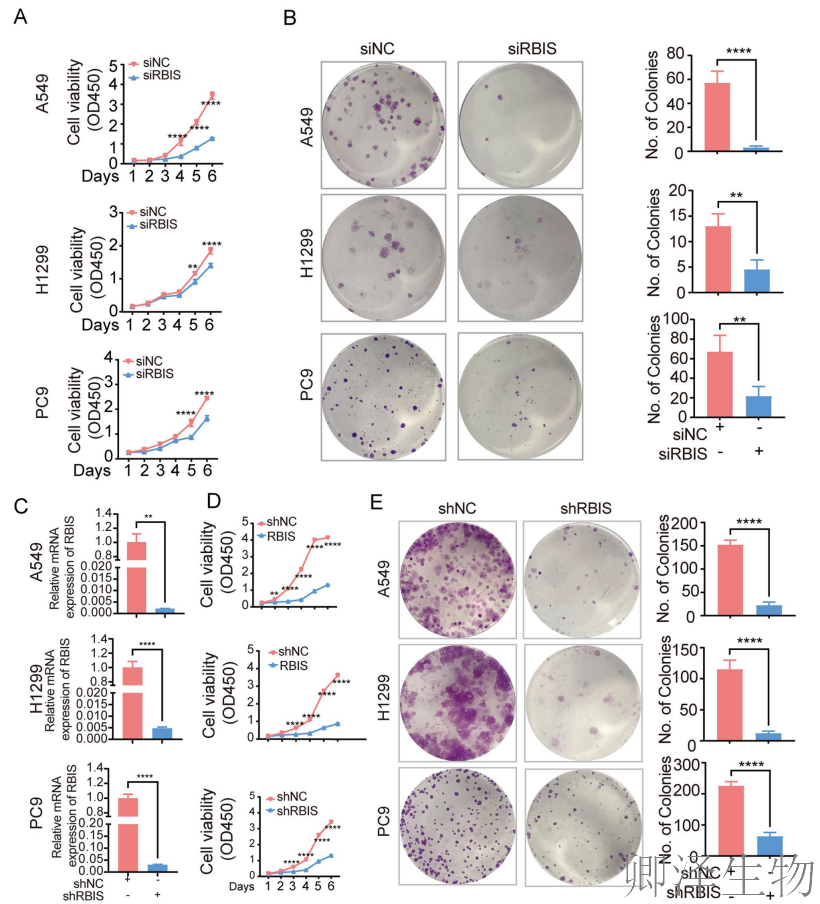
综上所述,这些结果表明RBIS的低表达在体外抑制了肺癌细胞的迁移和侵袭潜力。
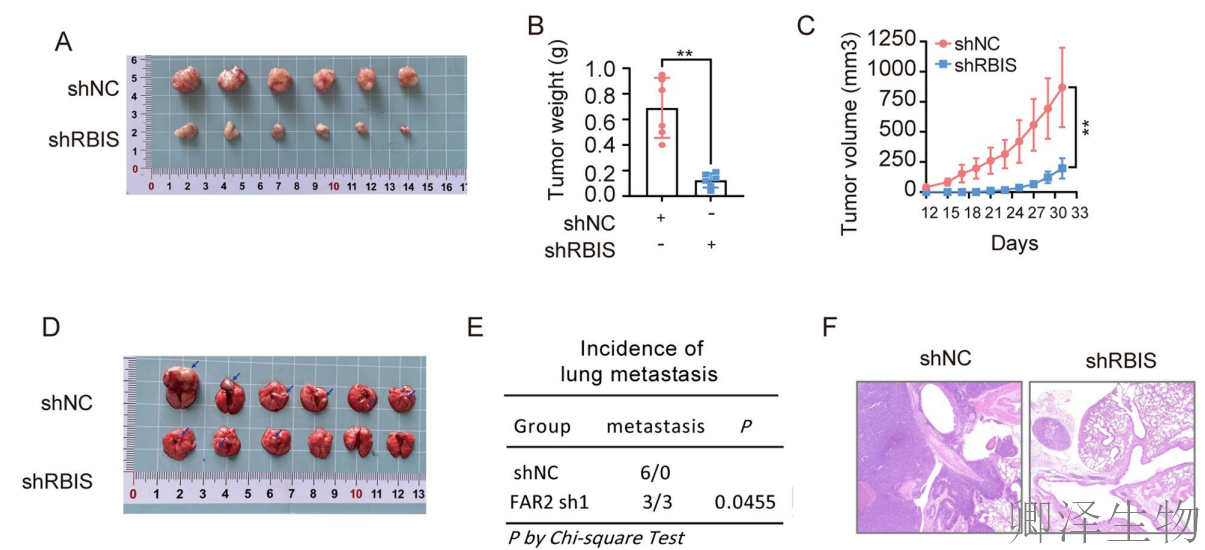
(3)敲低RBIS可抑制体内肺癌细胞的肿瘤生长和转移
同时,作者也证实RBIS基因敲低可明显抑制肺腺癌细胞在体内的生长和转移。
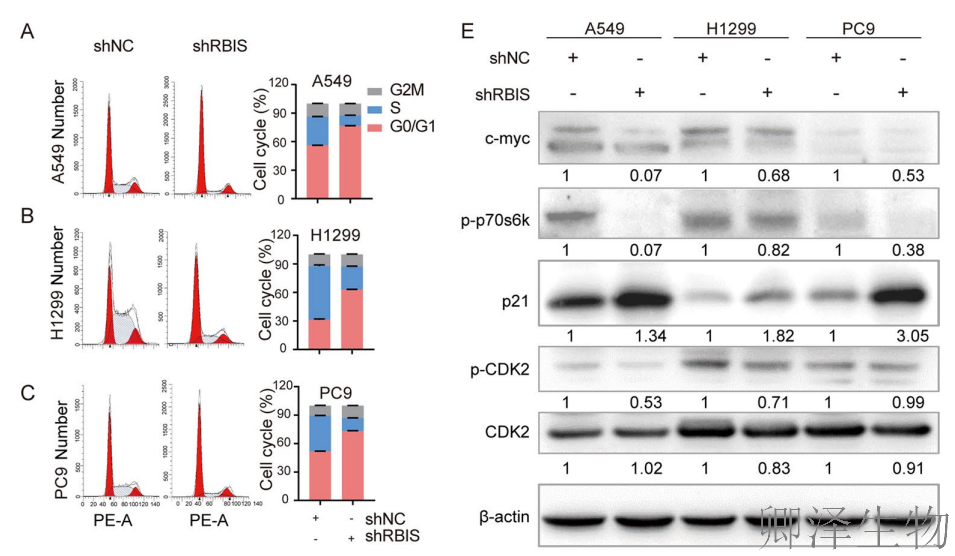
(4)RBIS的敲低可诱导显著的细胞周期阻滞和凋亡
随后,作者深入揭示了RBIS缺失抑制肺腺癌细胞生长的机制——通过诱导细胞周期阻滞和促进细胞凋亡。
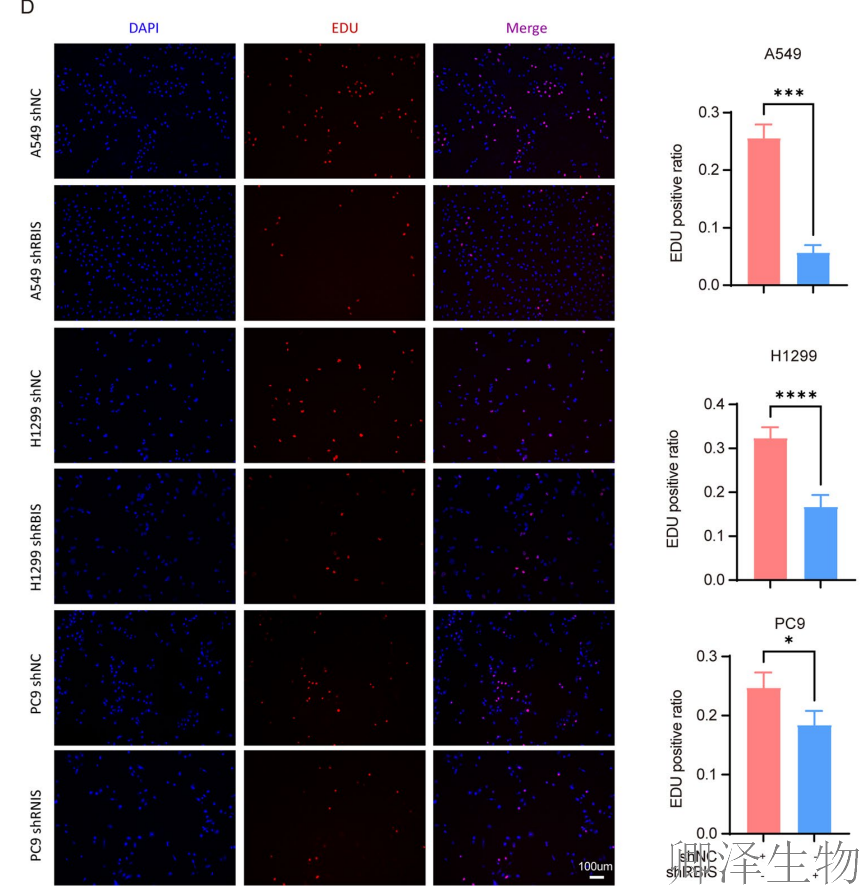
RBIS敲低导致细胞周期阻滞在G0/G1期(图5A-C),EdU实验证实DNA合成受阻(图5D)。分子机制上,c-myc、p-p70s6k等G1/S期关键促进因子表达下调,而周期抑制蛋白p21表达上调(图5E),从功能到分子层面完整揭示了RBIS调控细胞周期的通路。
细胞周期阻滞进一步触发了凋亡。流式细胞术显示RBIS敲低显著增加早期和晚期凋亡细胞比例(图6A-C),Western blot证实抗凋亡蛋白MCL-1表达下降(图6D)。更重要的是,体内实验同样验证了RBIS敲低能诱导移植瘤细胞凋亡(图6E,F)。
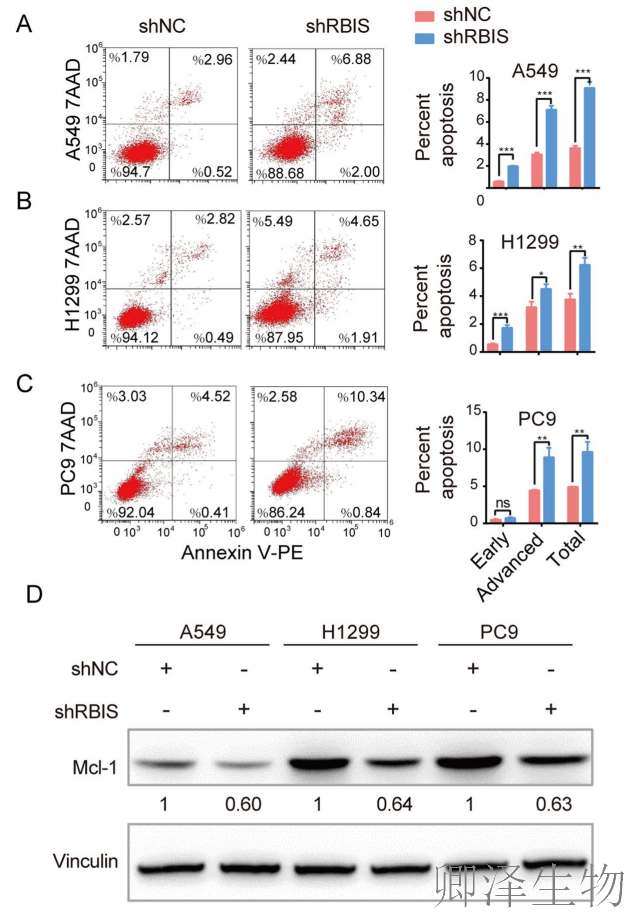
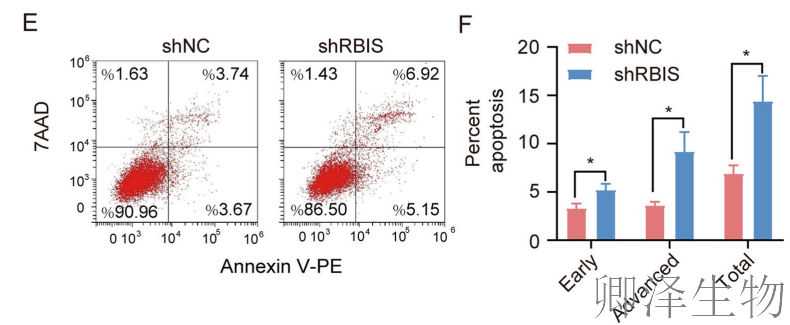
这些结果共同表明,RBIS通过调控细胞周期进程和凋亡通路,在肺腺癌细胞生长调控中发挥核心作用。
(5)在表达低水平RBIS的肺腺癌细胞中观察到核糖体生物合成受损
为了进一步阐明RBIS影响细胞周期和凋亡的机制是否与核糖体生物合成相关,作者首先检测了rRNA的转录,结果显示在A549细胞中敲低RBIS后,47S rRNA的表达显著降低(图7A-C)。
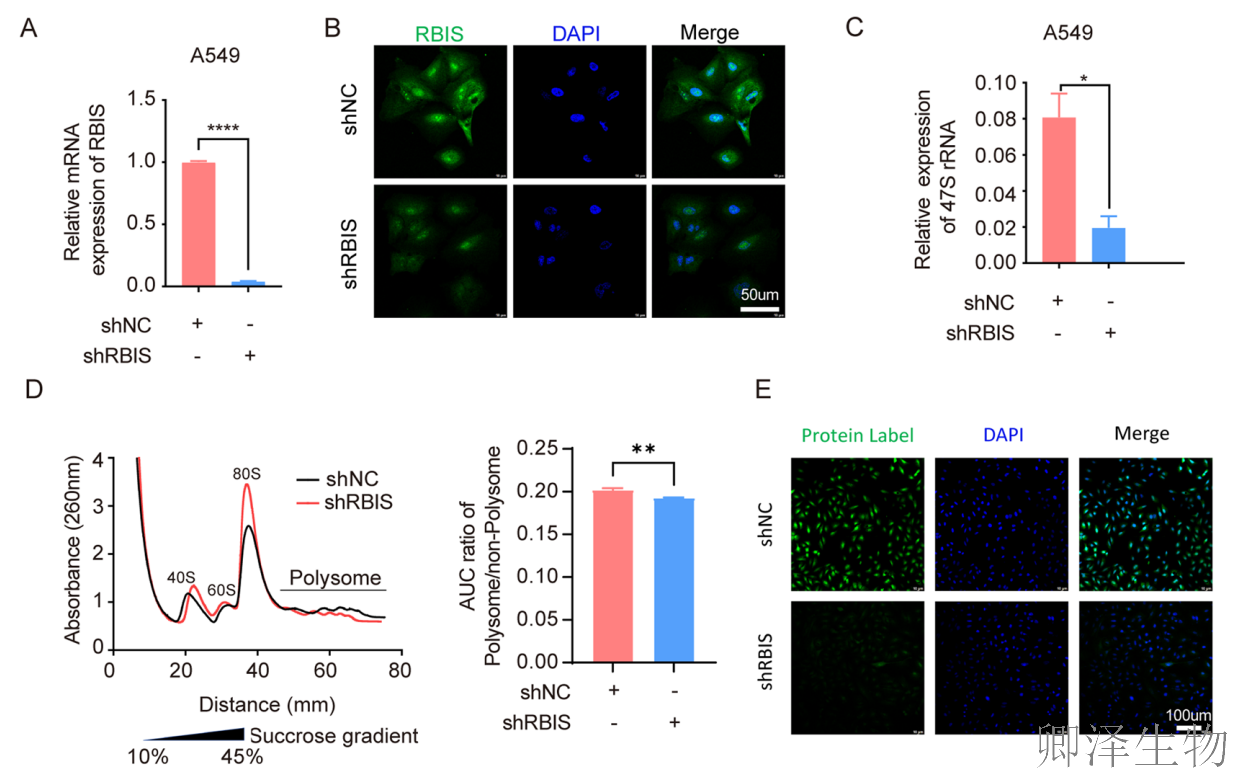
进一步研究了RBIS是否影响细胞内的蛋白质翻译效率。Polysome profiling分析结果显示,敲低RBIS降低了多聚核糖体与非多聚核糖体的比例(图7D)。结合全局蛋白合成实验直接证实RBIS敲低最终抑制了新生蛋白质的合成(图7E)。这表明RBIS是维持癌细胞高效蛋白质翻译工厂正常运转的关键因子。
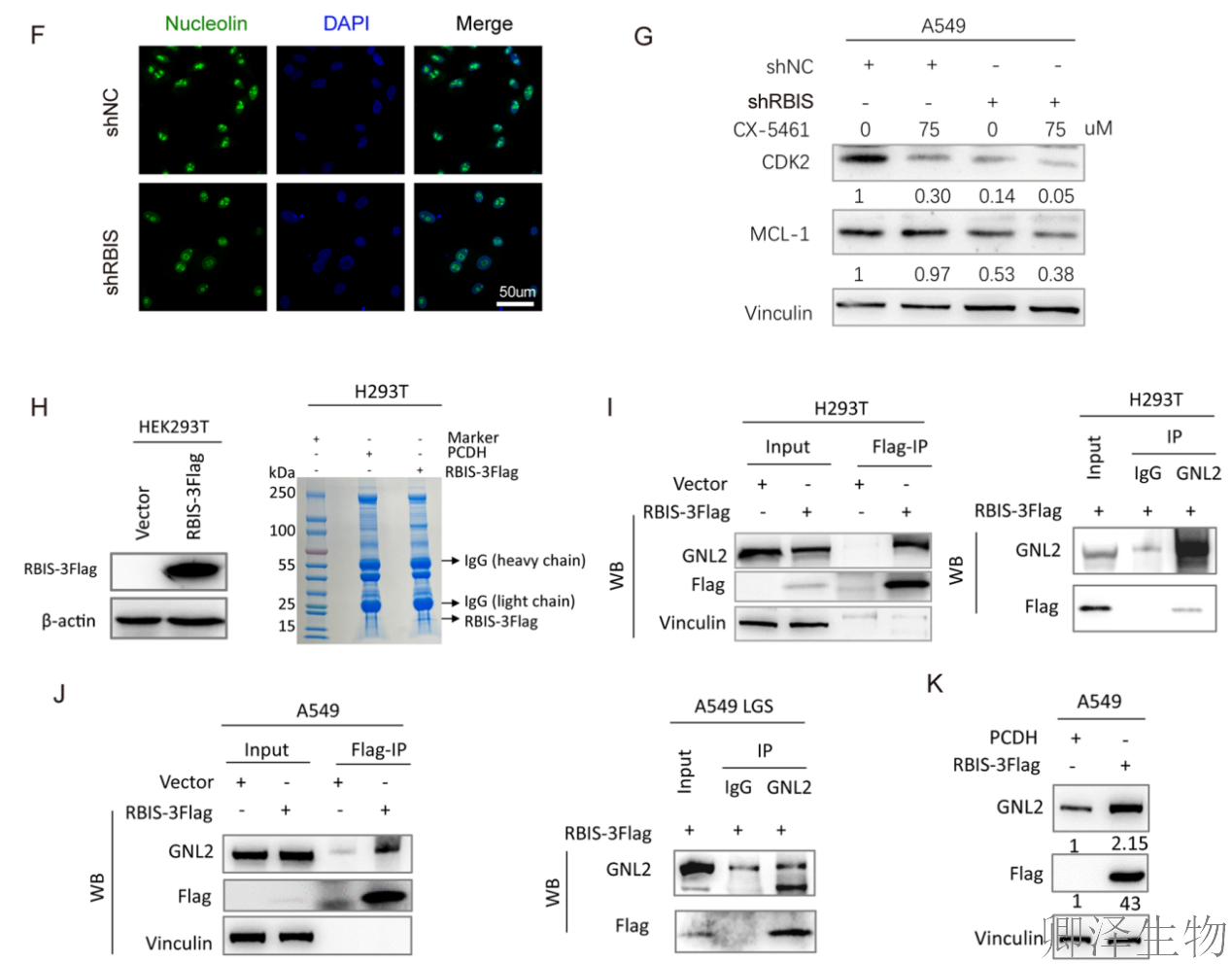
此外,RBIS缺失还引发了核仁形态异常(图7F),即核仁应激。机制上,研究人员通过Co-IP联合质谱分析,发现RBIS与核糖体成熟因子GNL2存在相互作用(图7H-K)。
GNL2已知参与60S大亚基的成熟,因此该结果揭示了RBIS影响核糖体组装的直接下游伙伴,将RBIS置于核糖体成熟通路的上游位置,初步绘制出“RBIS-GNL2-核糖体生物合成-蛋白翻译-肿瘤生长”的完整信号轴,为靶向核糖体治疗肺癌提供了新的理论依据和潜在靶点。
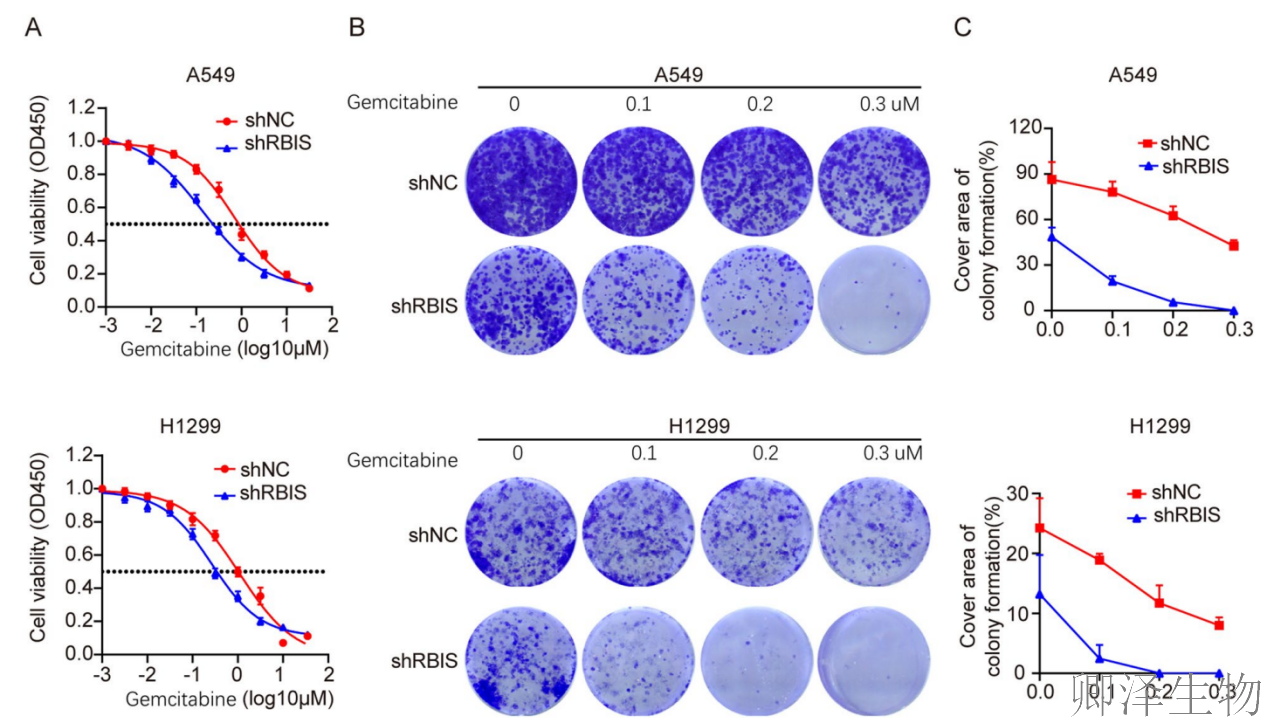
(6)敲低RBIS可增强肺腺癌细胞对吉西他滨的药物敏感性
最后,作者揭示了靶向RBIS在克服肺腺癌化疗耐药方面的潜在临床价值。
敲低RBIS显著降低了吉西他滨的IC50值,意味着细胞对药物的敏感性增强。更为直观的集落形成实验(图8B, C)进一步证实,在RBIS缺失背景下,吉西他滨以剂量依赖的方式更有效地抑制了癌细胞的存活与增殖。
研究总结
本项研究是运用多组学技术深入探索肿瘤机制的优秀范例。其中,Polysome Profiling技术扮演了承上启下的核心角色:
•它架起了基因功能(RBIS敲低)与表型(增殖抑制)之间的桥梁,将复杂的细胞表型归结于蛋白质翻译这一可量化的生物学过程。
•它提供了直观、定量的数据,强有力地证明了RBIS通过影响核糖体功能发挥作用。
作为本研究的技术服务支持方,我们深感荣幸。该研究的成功再次证明了Polysome Profiling技术在研究肿瘤、发育、神经疾病等涉及翻译调控领域的巨大价值。如果您的研究正面临类似挑战,欢迎联系我们,让前沿技术为您的研究插上翅膀!
欢迎致电了解详情或咨询!
广州卿泽生物科技有限公司
地址:广州市黄埔区伴河路96号一栋三层321房
电话:18925086102(微信同号)




