广州卿泽生物科技有限公司
6 年
手机商铺
- NaN
- 0.8999999999999999
- 1.9
- 0.8999999999999999
- 3.9
推荐产品
公司新闻/正文
【分子间博弈】 | Polysome技术协助破解脑卒中血管新生调控新机制!
50 人阅读发布时间:2025-11-12 15:48
导读:
脑卒中,特别是缺血性脑卒中,是全球范围内致残和致死的主要原因之一。当前,恢复血流是治疗的关键,但这一过程本身可能引发更严重的“二次伤害”——脑缺血再灌注损伤。如何在这种损伤中促进血管新生,快速重建缺血区域的血液供应,成为治疗的新希望。

今天解读的这项2025年发表于《Advanced Science》的研究,首次揭示了一个名为TUG1的长链非编码RNA,如何像一把“分子刹车”一样,抑制血管新生,从而加重脑损伤。更重要的是,研究团队精准找到了它“踩刹车”的分子靶点,为未来开发精准疗法提供了全新靶点。
文章索引:
标题:LncRNA TUG1 Repressed Angiogenesis by Promoting the Ubiquitination of HuR and Inhibiting Its Nuclear Translocation in Cerebral Ischemic Reperfusion Injury.
发表期刊:Adv Sci (Weinh).
发表时间:2025.03
作者团队:武汉大学人民医院神经外科 陈谦学教授团队
IF:14.1
DOI:10.1002/advs.202413333.
研究概览
本研究聚焦于两个关键分子:长链非编码RNA TUG1和RNA结合蛋白 HuR。

研究结果
(1)TUG1在体内和体外均抑制血管生成并加重脑缺血再灌注损伤
首先,作者发现长链非编码RNA TUG1在脑缺血再灌注损伤(CIRI)中扮演着抑制血管生成、加重病情的角色。
小鼠脑内TUG1过表达,会显著加重其神经功能缺损、脑水肿及脑梗死面积,表明TUG1过表达恶化了CIRI的后果。
从分子机制上看,TUG1的过表达直接导致了脑组织中两个关键的促血管生成因子——CD31(内皮细胞标志物)和VEGFA的蛋白水平显著下降。这一分子层面的变化,最终通过免疫组化分析在组织水平上得到证实:TUG1过表达小鼠缺血区域的微血管密度明显降低。
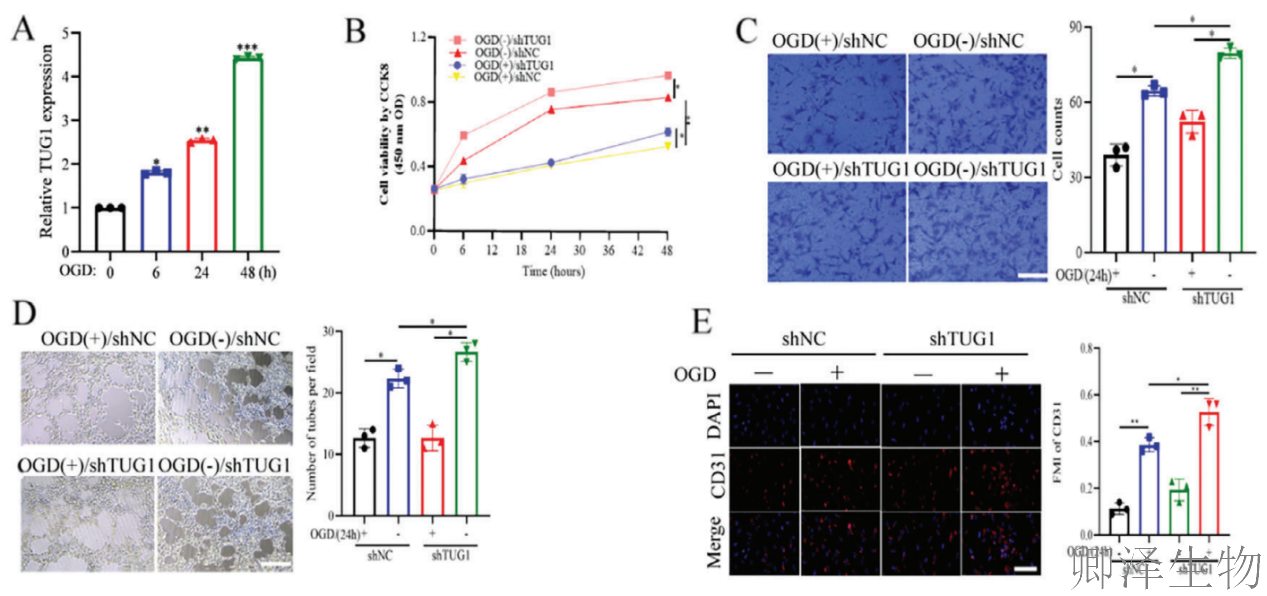
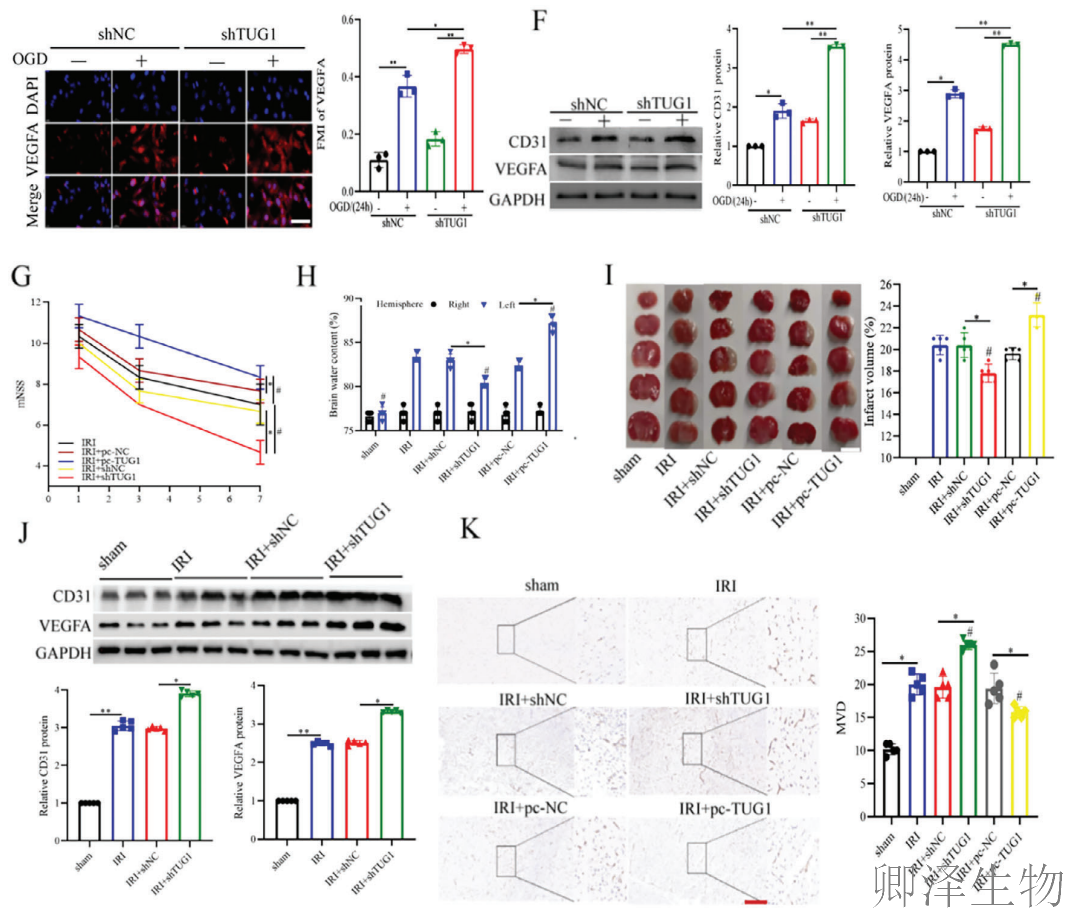
综上,TUG1是通过抑制CD31和VEGFA的表达,从而阻碍了损伤后的血管新生进程,最终加剧了CIRI。
(2)HuR促进血管生成并在体内和体外减轻CIRI
其次,作者发现RNA结合蛋白HuR在脑缺血再灌注损伤(CIRI)中发挥重要的保护作用。
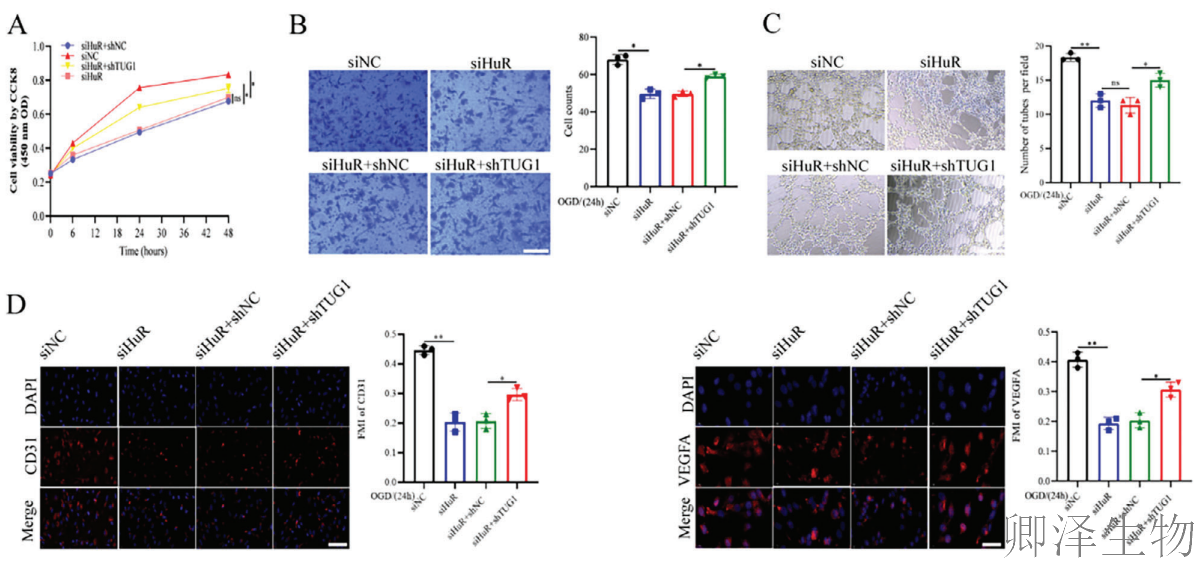
在细胞层面,HuR表达随缺氧时间延长而下降(图2A),敲低HuR显著抑制血管内皮细胞的增殖、迁移和成管能力(图2B-D),并降低CD31和VEGFA的表达(图2E-F)。在动物模型中,HuR敲低加重了神经功能缺损(图2G)、脑水肿和梗死体积(图2H-I),同时显著降低了缺血脑组织的微血管密度(图2K)及CD31、VEGFA蛋白水平(图2J)。相反,HuR过表达则产生完全相反的保护效果。
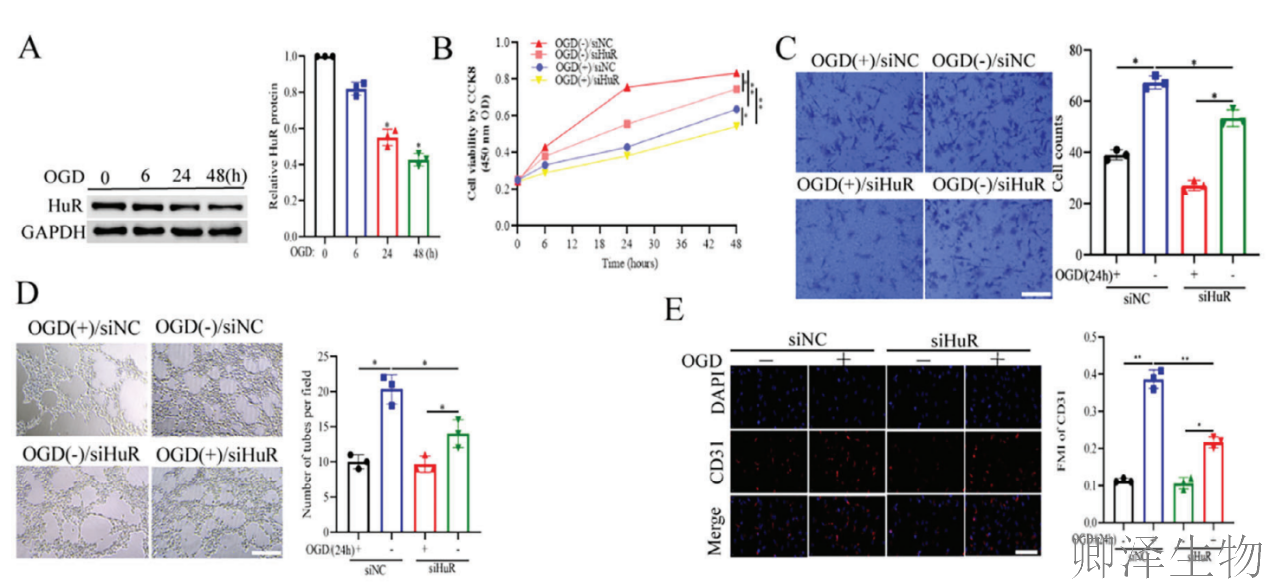
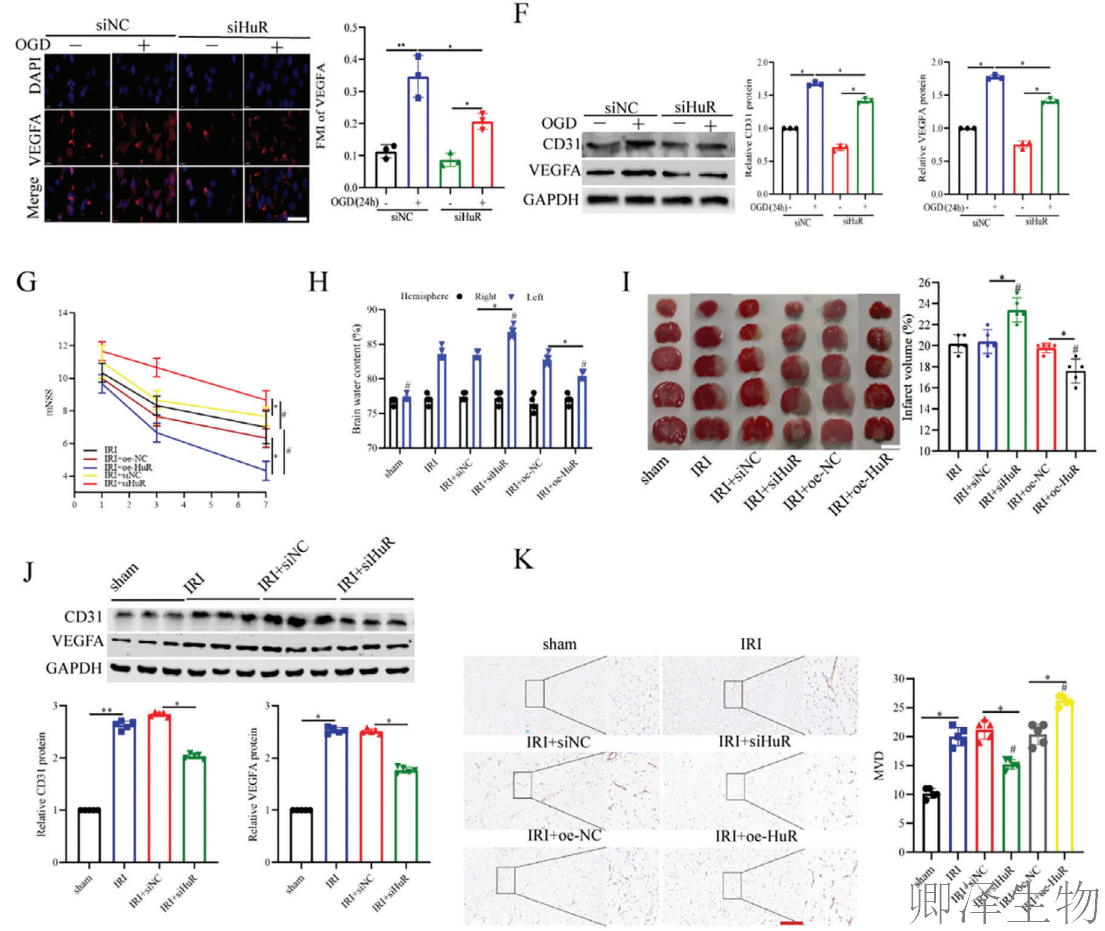
这些结果从细胞到动物水平完整证实,HuR是通过促进血管新生来缓解CIRI的关键保护因子。
(3)HuR通过靶向VEGFA mRNA促进血管生成
为探究HuR潜在的血管生成机制,作者对HUVEC细胞进行了短期OGD培养继而再灌注24小时。根据结果,HuR以时间依赖性的方式从细胞核转移至细胞质(图3A)。此外,细胞分步分离实验显示,经OGD/R处理后,HuR的核质比下降(图3B)。这些发现表明,OGD/R处理可诱导HuR从细胞核转运至细胞质。
根据FISH分析结果,HuR与VEGFA mRNA存在共定位(图3C)。随后,通过RIP实验证实了HuR与VEGFA mRNA之间的靶向结合(图3D)。同时进行的CLIP实验表明,HuR与VEGFA mRNA的结合主要富集在355-515位点(图3E)。另外,在使用CHXD处理HUVEC后检测VEGFA mRNA水平,发现敲低HuR会降低VEGFA mRNA的半衰期,而过表达HuR则产生相反效应(图3F)。
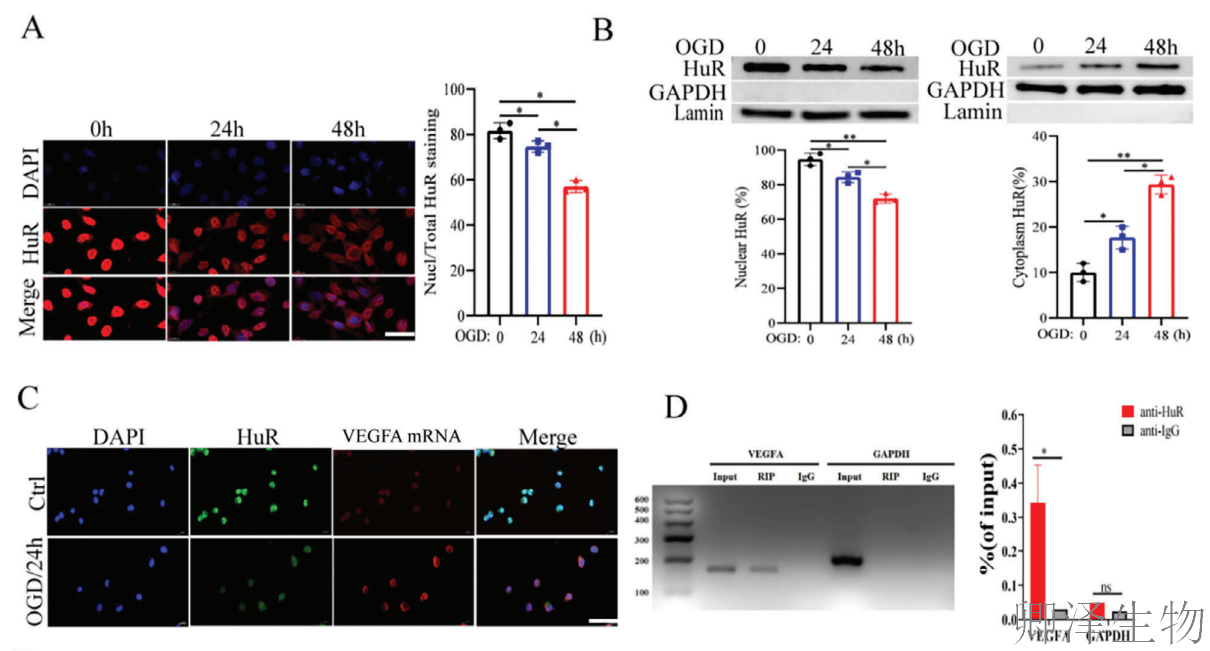
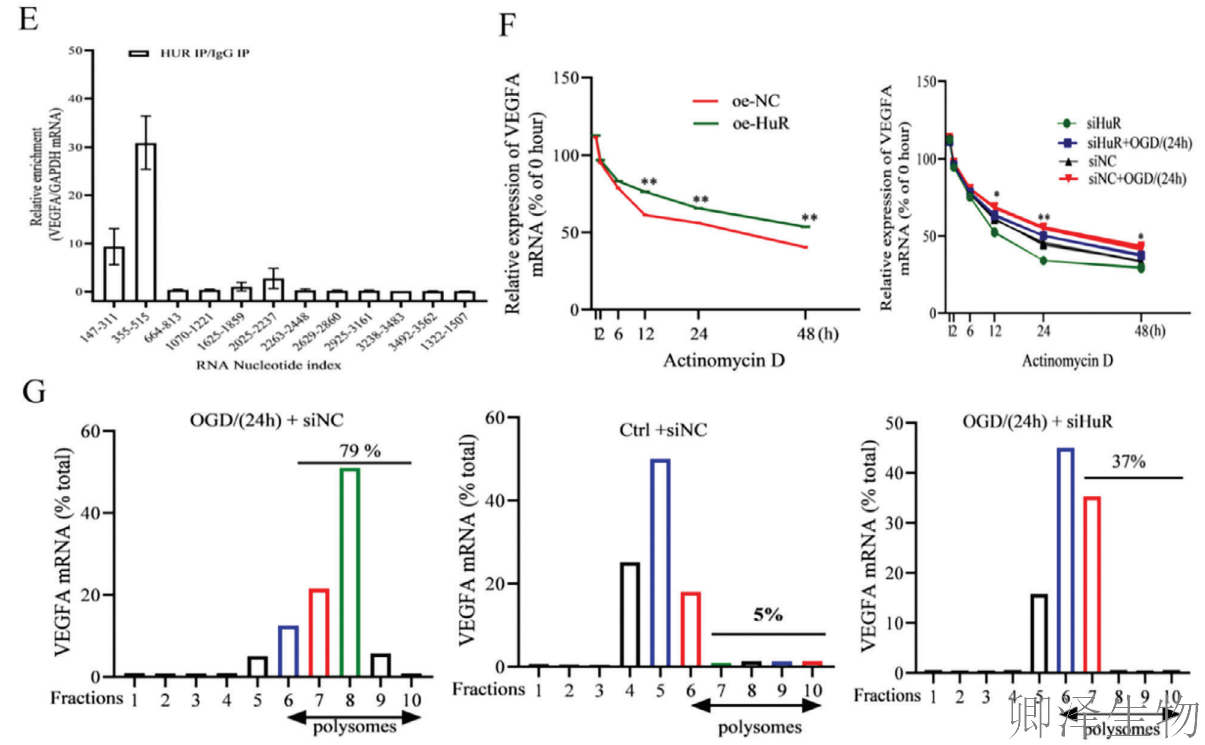
Polysome profiling分析显示,在未经处理的HUVEC中,仅有5%的VEGFA mRNA与多聚核糖体组分相关,而在OGD/R处理的HUVEC中,这一比例提高至79%。同时,在沉默HuR后,多聚核糖体组分中的VEGFA mRNA丰度降至37%(图3G)。
这些发现共同表明,HuR通过结合VEGFA mRNA并增强其稳定性来促进血管生成。
(4)TUG1 与 HuR 相互作用
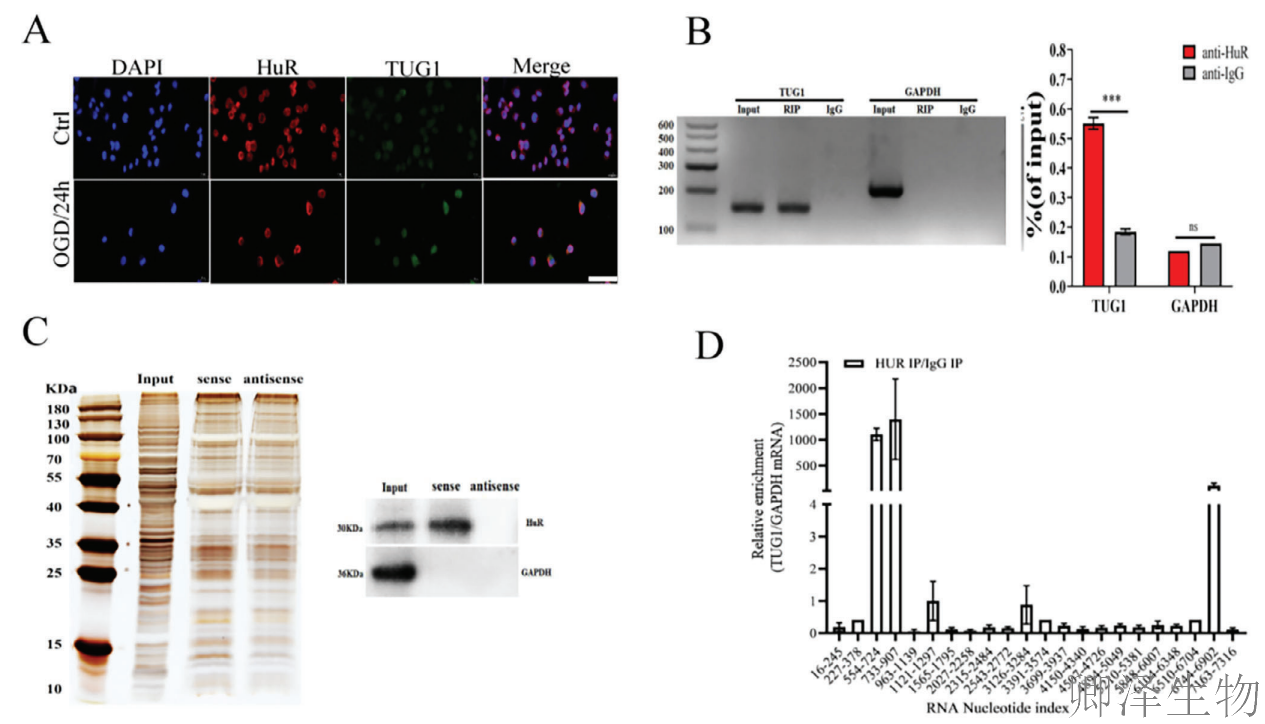
为了进一步确定TUG1是否在OGD/R‐诱导的HUVECs中与HuR相互作用,作者使用FISH试验进行了亚细胞定位分析,揭示了TUG1‐HuR在HUVECs中的共定位(图4A)。此外,RIP实验显示TUG1可以直接与HuR结合,RNA pull - down实验也证实了这一现象(图4B,C)。此外,CLIP分析显示TUG1和HuR之间的直接结合主要富集在554-724、733-907和6744-6902位点(图4D)。这些发现共同证实了TUG1-HuR的结合。
(5)TUG1抑制了HuR的核转位并促进其泛素化降解
随后,作者揭示出lncRNA TUG1通过双重分子机制抑制HuR蛋白的功能:"囚禁"其于核内,并加速其降解。
首先,TUG1过表达会抑制HuR从细胞核向细胞质的正常转运,将其"困"在核内,阻止其进入细胞质发挥稳定VEGFA mRNA的功能(图5A-B)。更重要的是,TUG1还扮演了"分子刽子手"的角色。它并不影响HuR的mRNA水平,却显著降低HuR蛋白的稳定性(图5C-D)。
机制探寻表明,蛋白酶体抑制剂MG132能逆转这一降解过程(图5E),而最终实验证实,TUG1过表达显著增强了HuR的泛素化修饰水平(图5F),这是蛋白被标记降解的关键信号。
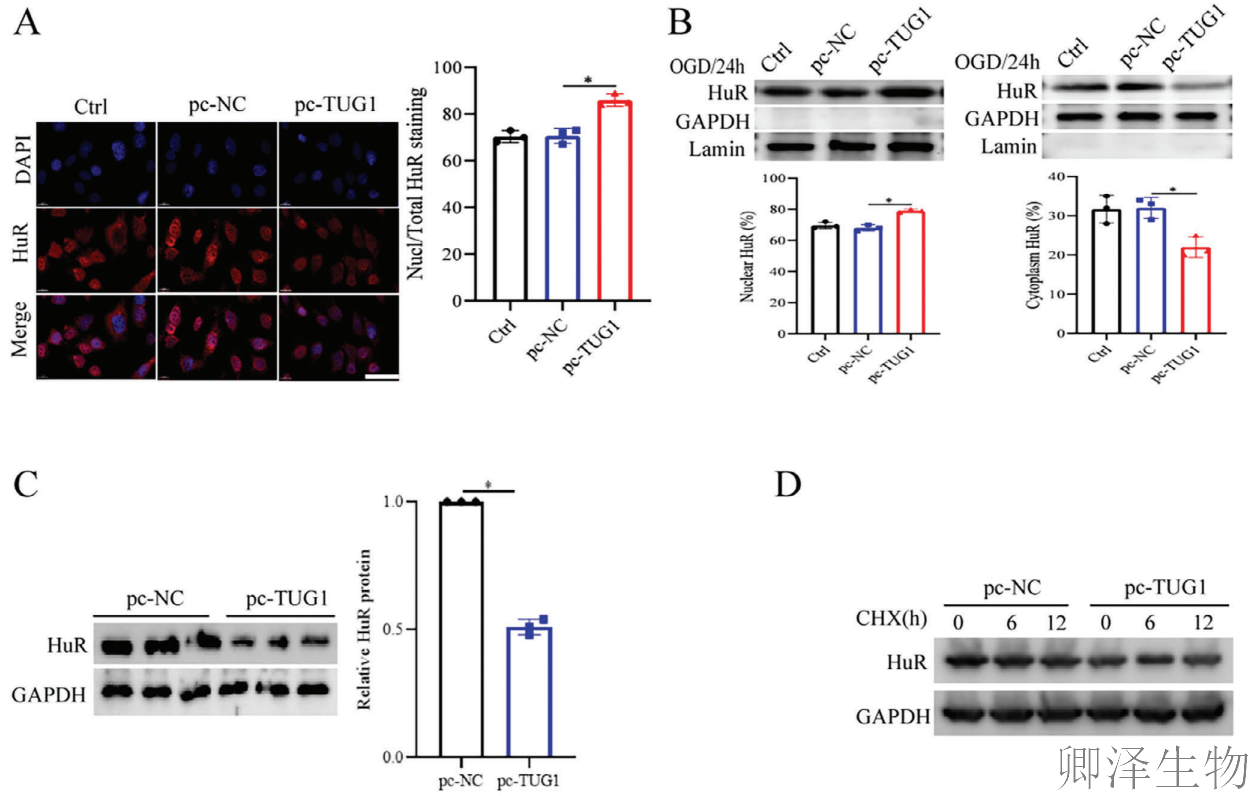
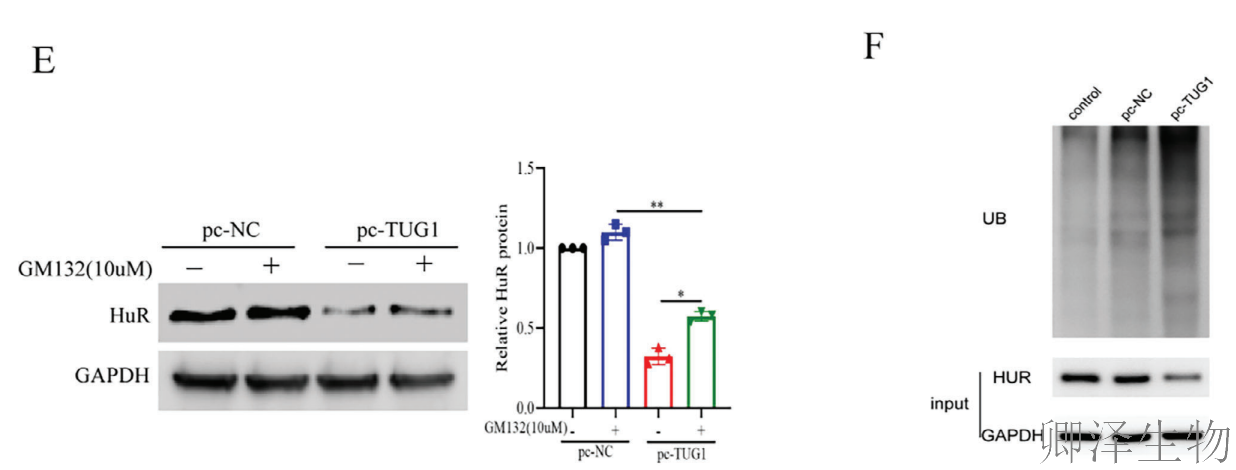
综上所述,TUG1通过抑制HuR核转位和促进其泛素-蛋白酶体途径降解这两种方式,精准地削弱了HuR的促血管生成功能,从而加重脑缺血再灌注损伤。
(6)TUG1可在体内和体外逆转HuR的血管生成作用
最后,作者梳理出lncRNA TUG1通过靶向HuR/VEGFA轴发挥血管生成抑制作用。
在细胞层面,TUG1敲低能够有效挽救HuR缺失导致的血管生成功能缺陷,显著改善HuR敲低细胞的增殖、迁移和成管能力(图6A-C),并上调CD31和VEGFA表达水平(图6D-E)。
机制上,TUG1过表达显著缩短VEGFA mRNA的半衰期(图6F),此外,Polysome profiling分析显示,对照组和TUG1过表达组之间多聚核糖体组分中VEGFA mRNA丰度存在显著差异(图6G)。这些发现表明,TUG1抑制了OGD/R处理的HUVEC中VEGFA mRNA的稳定性。
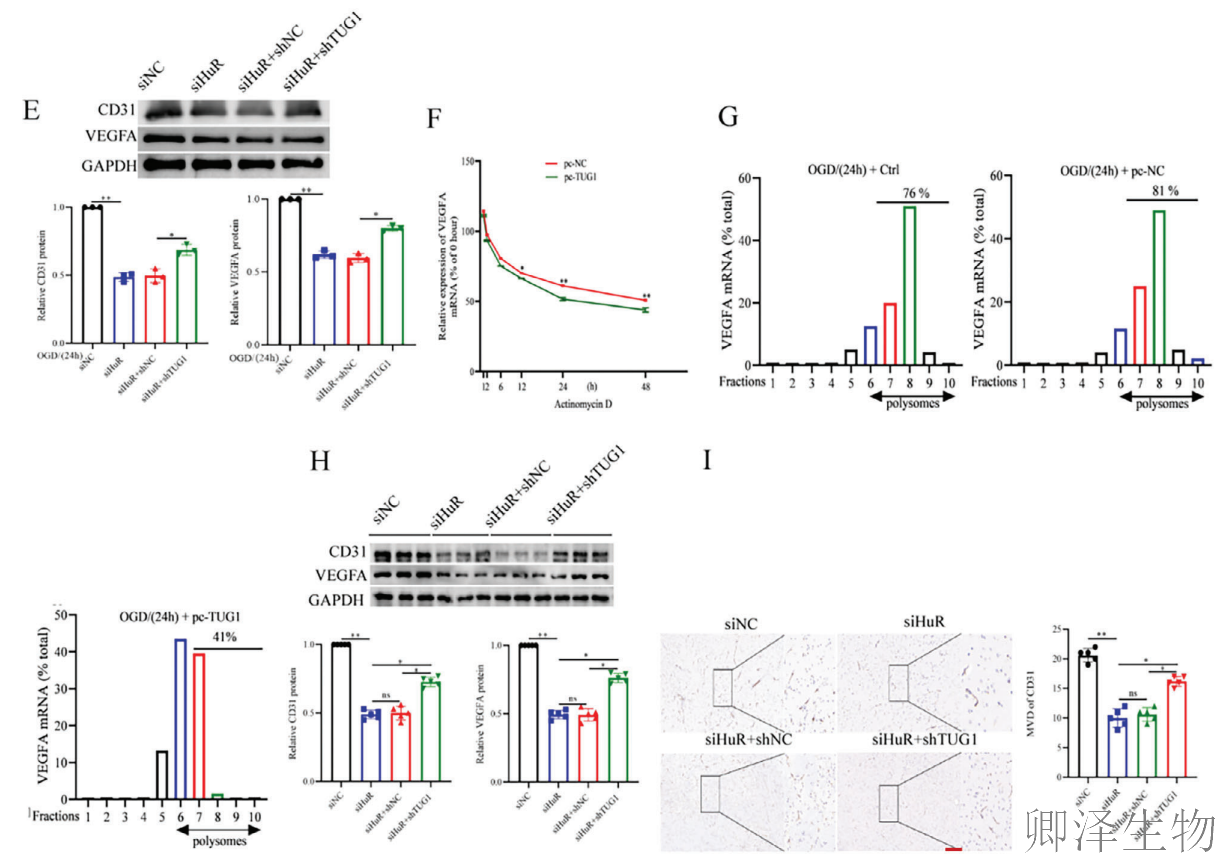
在动物实验中,同时敲低TUG1和HuR的小鼠表现出比单独敲低HuR更高的CD31、VEGFA蛋白水平和微血管密度(图6H-I)。这些结果从分子到整体水平完整证实,TUG1位于HuR信号通路的下游,通过调控HuR/VEGFA轴在脑缺血再灌注损伤中发挥关键作用,TUG1-HuR-VEGFA构成了一条完整的血管生成调控通路。这一发现为开发针对TUG1-HuR相互作用界面的治疗策略提供了重要理论依据。
研究结论
本研究清晰地描绘了一条全新的信号轴:TUG1 → HuR → VEGFA mRNA稳定性/翻译效率 → 血管新生。
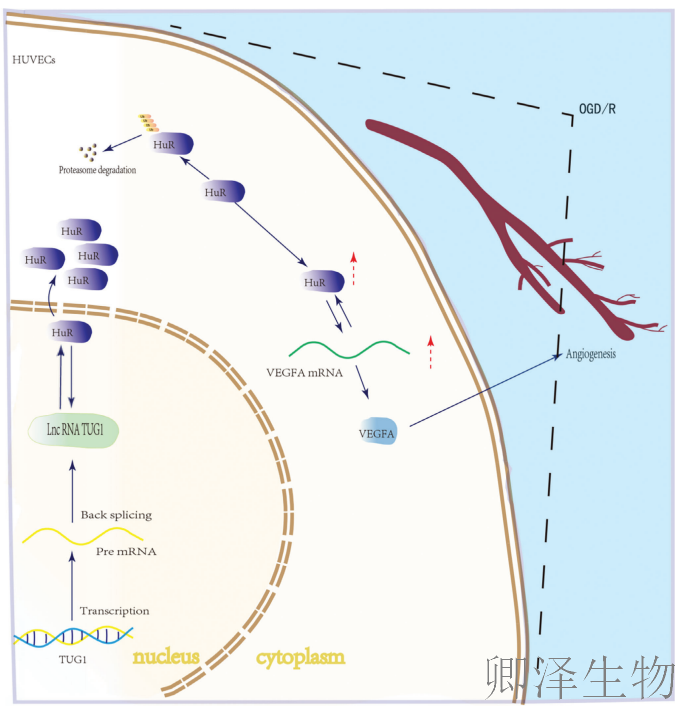
在脑缺血再灌注损伤中,高表达的TUG1通过直接结合HuR蛋白,一方面抑制其进入细胞质发挥功能,另一方面促进其发生泛素化降解,从而从转录后稳定性和翻译效率两个层面削弱了HuR对VEGFA的促进作用,最终抑制了血管新生,加重了脑损伤。
欢迎致电了解详情或咨询!
广州卿泽生物科技有限公司
地址:广州市黄埔区伴河路96号一栋三层321房
电话:18925086102(微信同号)



