广州卿泽生物科技有限公司
6 年
手机商铺
- NaN
- 0.8999999999999999
- 1.9
- 0.8999999999999999
- 3.9
推荐产品
公司新闻/正文
【核糖体调控蛋白】 | 癌细胞刹车失灵!eIF6如何引发癌症“连环车祸”?
22 人阅读发布时间:2025-12-02 14:52
导读:
当我们谈论癌症时,我们往往关注的是那些直接控制细胞生长和分裂的基因。然而,现有研究将焦点转向了一个更为基础的细胞过程——蛋白质合成,并揭示了其中关键调控因子eIF6在癌症进展中扮演的关键角色。

细胞内的核糖体就像一个高效的蛋白质生产工厂,由两个主要部分组成:40S和60S两个亚基。eIF6就是这个工厂的“门卫”,控制着两个亚基何时可以结合形成完整的80S核糖体,开始合成蛋白质。正常情况下,eIF6会暂时阻止两个亚基的过早结合,确保蛋白质合成有序进行。
然而,在多种癌症中,这个“门卫”的数量异常增多,科学家们一直想弄清楚这是否与癌症的恶性进展直接相关。
文章索引:
标题:Sequestration of ribosomal subunits as inactive 80S by targeting eIF6 limits mitotic exit and cancer progression.
发表期刊:Nucleic Acids Research.
发表时间:2025.02
作者团队:美国圣路易斯大学生物系 Sofia Origanti团队
IF:13.1
DOI:10.1093/nar/gkae1272.
研究结果
(1)eIF6-N106S突变体中p53介导的细胞周期检查点反应的激活
首先,研究揭示了eIF6-uL14相互作用破坏后引发的细胞级联反应:通过结构分析(图1A)和基因编辑模型(图1B),证实eIF6-N106S突变虽不影响蛋白表达,但能显著抑制癌细胞增殖;
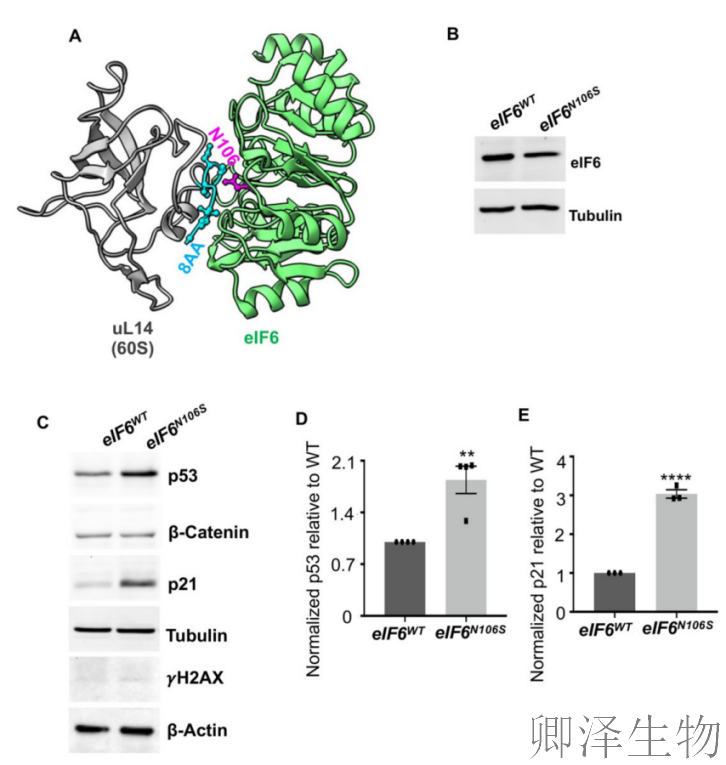
进一步机制探索显示,突变激活了p53-p21通路(图1C-E),但未引发DNA损伤(γH2AX无变化),表明这种增殖抑制源于核糖体应激而非遗传毒性,为靶向eIF6界面治疗癌症提供了理论依据。
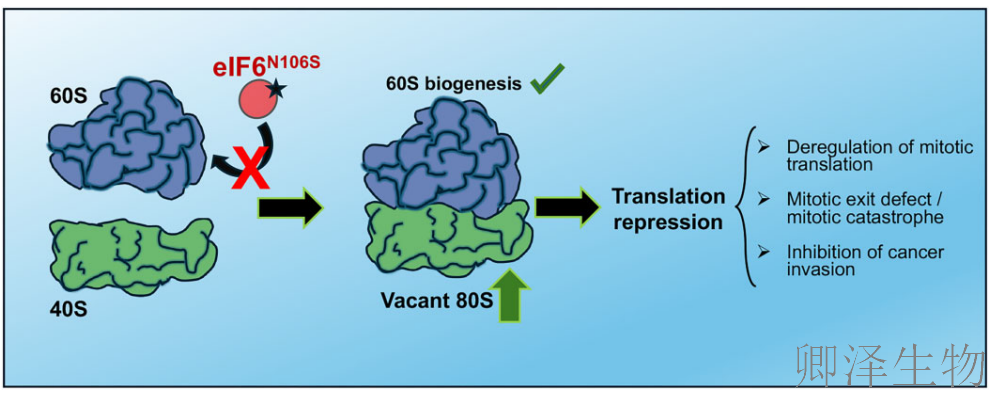
(2)eIF6–60S相互作用破坏后,空载80S核糖体水平升高且翻译受到抑制
为深入理解核糖体应激,作者评估了eIF6-N106S突变体的Polysome图谱。突变细胞显示80S单核糖体峰增加而多聚核糖体峰减少,表明全局翻译活性在突变体中显著降低(图2A-E)。基于甲硫氨酸类似物(AHA)的点击化学反应测定也证实突变体的总体翻译速率下降(图2F)。
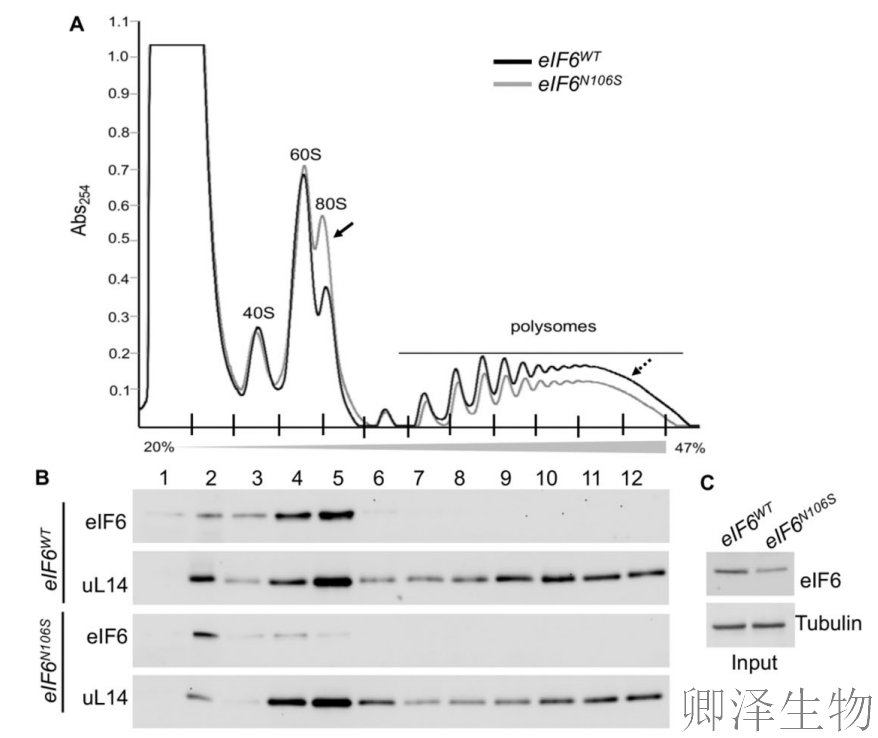
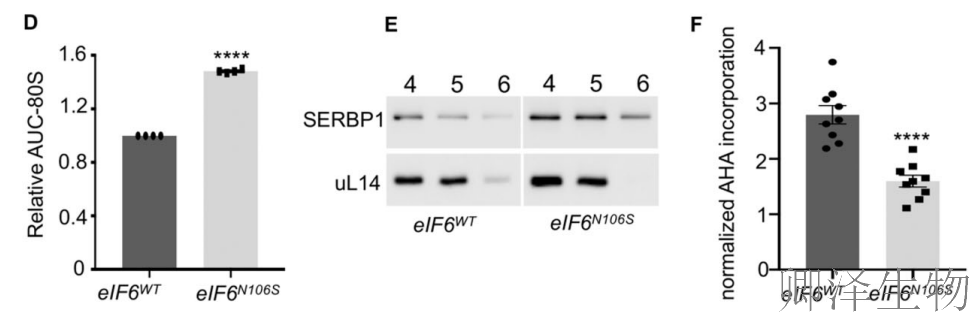
为确定eIF6突变体与60S亚基的结合情况,作者评估了eIF6在非核糖体组分与游离60S组分中的相对分布(图2B-C)。正如预期,eIF6-WT与60S亚基结合,而eIF6-N106S突变体在非核糖体组分中的丰度高于游离60S亚基组分(图2B)。
这些结果提示uL14结合的破坏足以阻碍其与60S亚基的相互作用。这也表明,eIF6与60S亚基结合减少导致空载80S单核糖体峰增加,原因是缺乏eIF6的抗结合活性时,60S与40S亚基发生异常结合。
(3)eIF6的核仁定位不依赖于BCCIP或uL14
eIF6定位到不同的核仁和细胞质区室归因于其在60S亚基生物发生和抗结合活性中的不同作用。因此,作者探究了eIF6的亚细胞分布。
细胞分馏实验(图3A-C)显示突变体eIF6胞质分布增加而核定位减少,免疫荧光分析(图3D-E)进一步证实核内eIF6信号减弱但核仁染色保持强烈,提示核仁招募机制未受损;免疫共沉淀实验(图3F-G)揭示突变体完全丧失与BCCIP的相互作用。
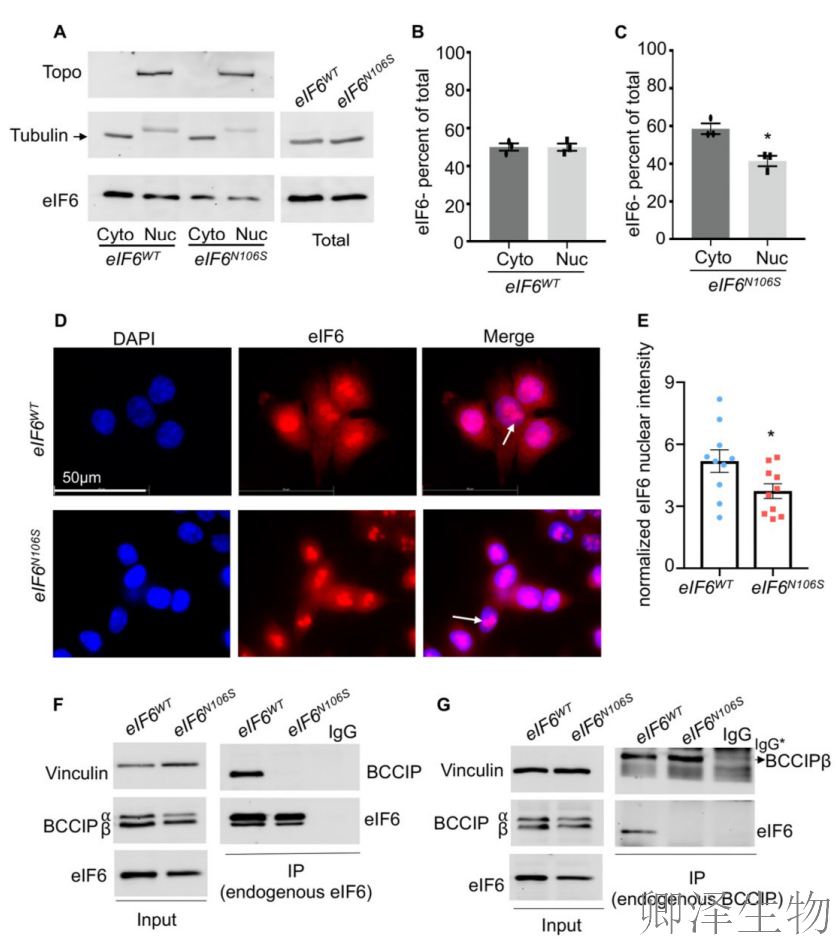
这些结果共同表明,eIF6的核仁定位不依赖于其与uL14或BCCIP的结合界面,突显了核仁滞留机制的独立性,并为eIF6在核糖体生物发生中的功能分离提供了关键证据。
(4)eIF6-N106S突变失调有丝分裂翻译和进程
随后,作者借助系统排除法揭示了eIF6-N106S突变引发翻译抑制的特异性机制。
Western blot分析(图4A-C)显示关键翻译起始因子(如4EBP1、eIF4E)及其磷酸化状态均无变化,表明经典起始通路未受影响;eIF6释放因子SBDS和EFL1水平也无补偿性调整(图4D),排除了核糖体成熟环节的间接效应。这些数据共同印证翻译缺陷直接源于eIF6-60S相互作用破坏导致的80S核糖体可用性失衡。
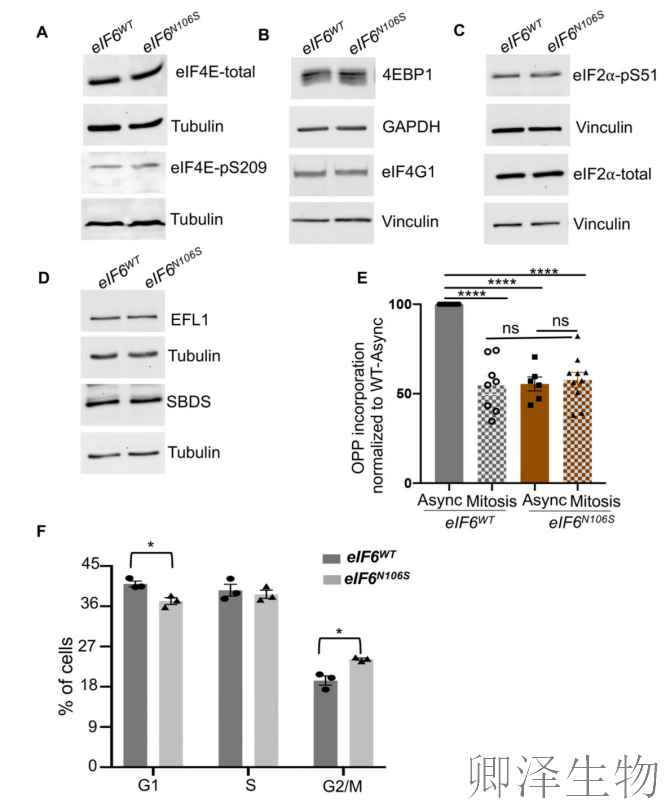
进一步研究发现,突变体在有丝分裂期丧失翻译抑制的生理性下调能力(图4E),这种有丝分裂翻译失调最终引发细胞周期G2/M期阻滞(图4F),揭示eIF6通过调控核糖体动态直接影响细胞分裂进程的精细调控。
同时,作者更揭示了eIF6-N106S突变引发有丝分裂灾难的完整路径:免疫荧光分析显示突变体出现显著的双核细胞增多(图5A-B)和典型有丝分裂灾难特征(图5C-D),证实细胞分裂严重异常;关键的染色体分离缺陷证据来自于染色质桥(图5E-F)和后期桥/滞后染色体现象(图5G-H),直接解释分裂错误根源;延时活细胞成像(图5I-J)精准捕捉到从胞质分裂到G1期进程的显著延迟,而进入有丝分裂的指标正常,说明缺陷特异发生在分裂后期阶段。
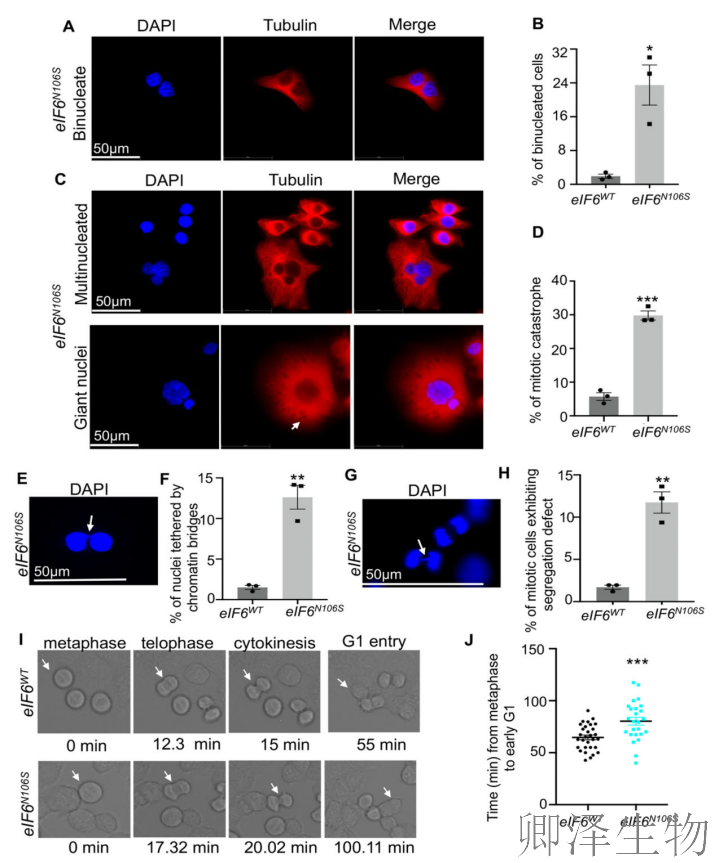
这些发现完整勾勒出"eIF6功能失调→翻译紊乱→染色体分离错误→胞质分裂阻滞→有丝分裂灾难"的因果链条,为理解核糖体调控如何直接影响基因组稳定性提供了重要证据。
(5)Ribo-seq揭示了eIF6-N106S突变体中有丝分裂关键基因的翻译效率发生改变
为了更好地理解导致有丝分裂缺陷的翻译失调,作者进行了Ribo-seq和RNA-seq来测量揭示了eIF6-N106S突变引发翻译效率全局重编程的机制。
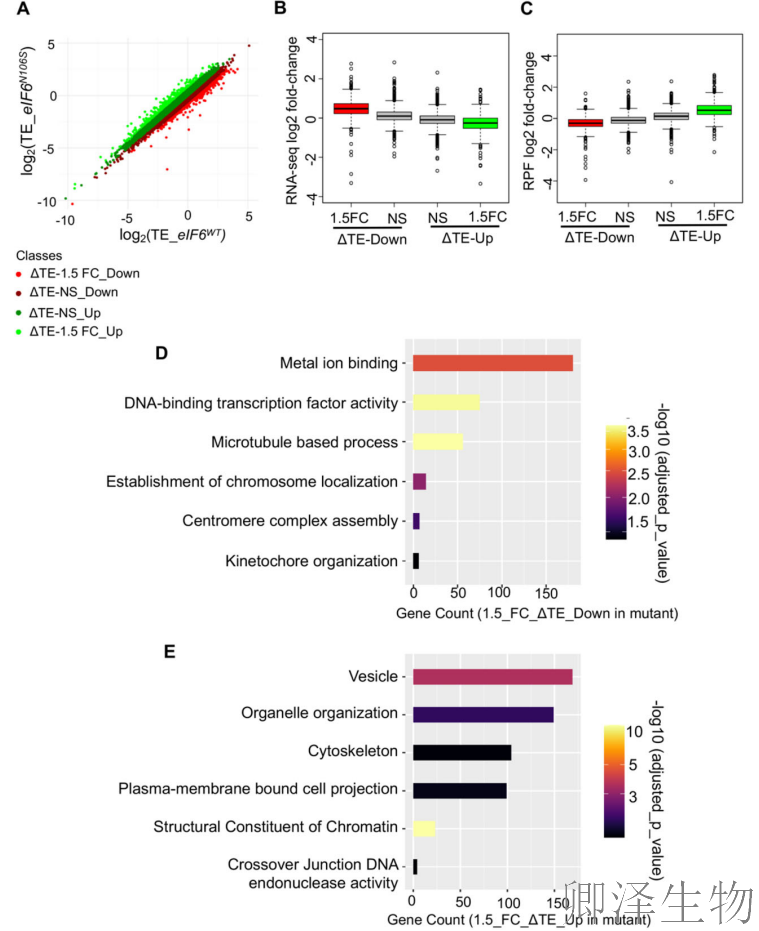
ΔTE分布图(图6A)显示突变体中大量基因表达失调,其中下调基因伴随mRNA水平轻微升高而RPF减少(图6B),上调基因则相反(图6C),表明翻译速率变化反向调控转录稳定性;GO分析(图6D)突显有丝分裂动粒和染色体定位相关基因的翻译效率显著下调,直接解释突变体染色体错位的根源;同时核小体组件TEs增加(图6E)提示染色质结构重塑,进一步加剧有丝分裂缺陷。
接着,作者揭示了eIF6-N106S突变通过转录本结构特异性调控和关键转移因子抑制双重机制影响癌细胞功能的完整路径(图7)。
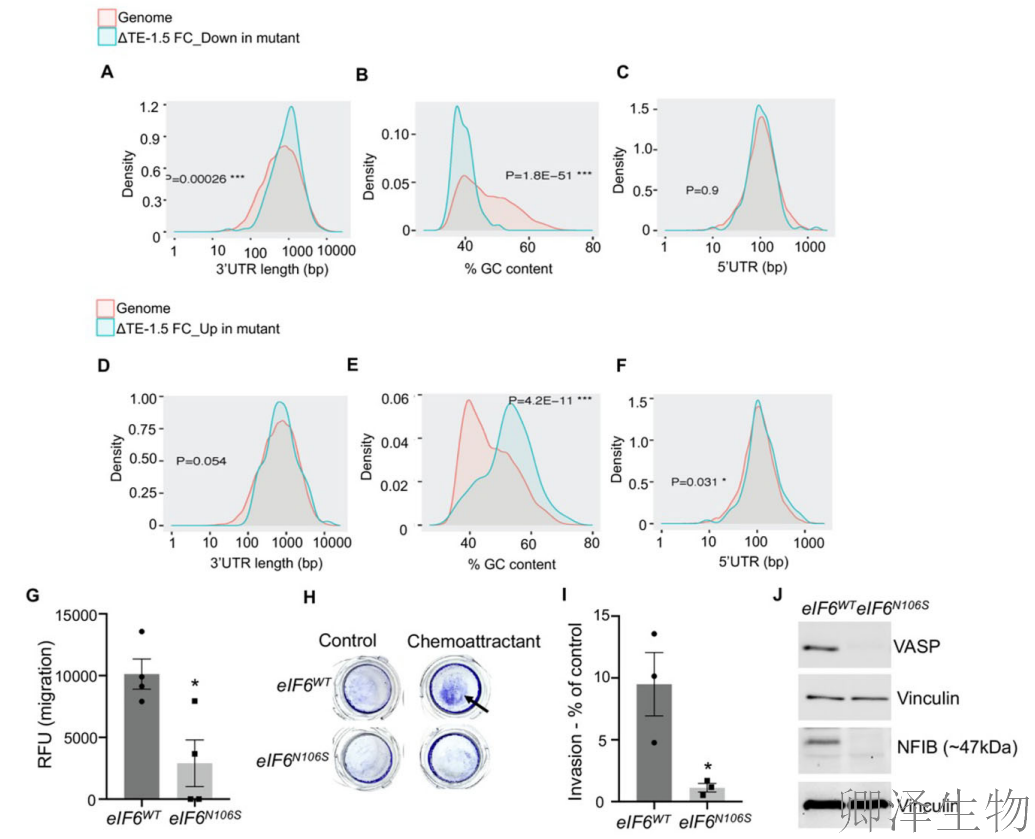
这些发现完整勾勒出"eIF6功能失调→翻译重编程(结构偏好性)→关键转移因子表达缺失→侵袭能力抑制"的因果链条,为理解核糖体调控如何精确影响癌症恶性进展提供了多维度证据。
(6)eIF6-N106S突变在皮下肿瘤异种移植模型中抑制结肠癌侵袭
作者通过体内外结合实验体系,完整揭示了eIF6-N106S突变对癌症恶性行为的抑制作用。
首先通过荧光素酶标记技术建立可视化追踪系统(图8A),筛选获得生物发光信号一致的细胞克隆(图8B),并验证突变细胞仍保持增殖活性(图8C),确保实验体系可靠性。
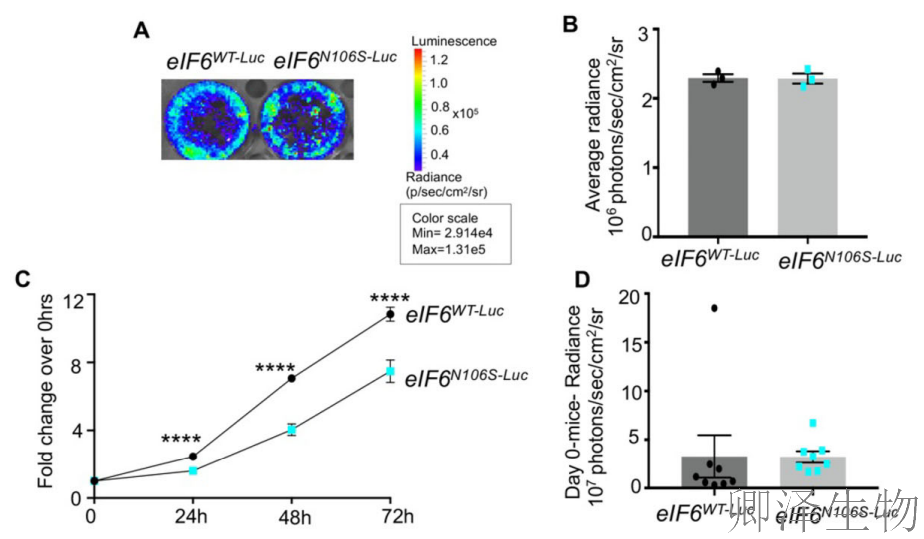
动物实验显示,野生型肿瘤呈现典型侵袭特征——50%的小鼠发生腹膜转移和肝转移(图8E);而突变组即使肿瘤体积增大至需终止实验时,仍保持原位生长状态,无一例出现侵袭(图8G)。尤为关键的是,突变组原发肿瘤生长速度显著减缓(图8D)。
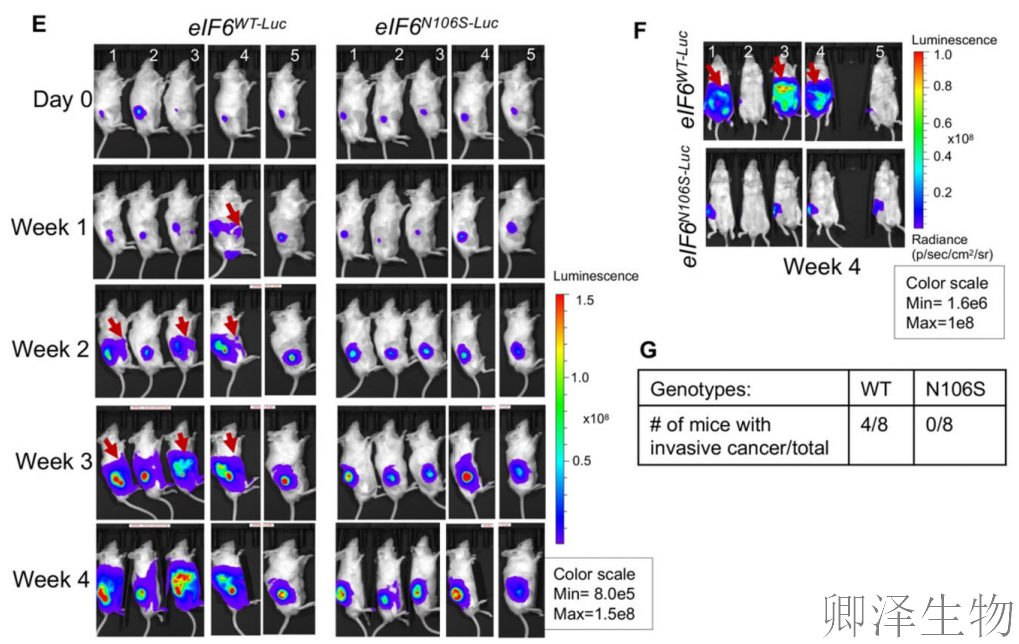
(7)eIF6主要在高级别侵袭性癌症中过表达
最后,作者通过临床样本与细胞系模型的双重验证,揭示了eIF6表达与癌症恶性程度的特异性关联。
膀胱癌模型分析:高级别膀胱癌细胞系(图9A-B)及配对患者样本(图9C-D)均显示eIF6在细胞质和核仁特异性高表达,而低级别癌症与良性组织无差异(图9E),表明eIF6过表达是侵袭性演进的"伴随标志"而非普遍现象。
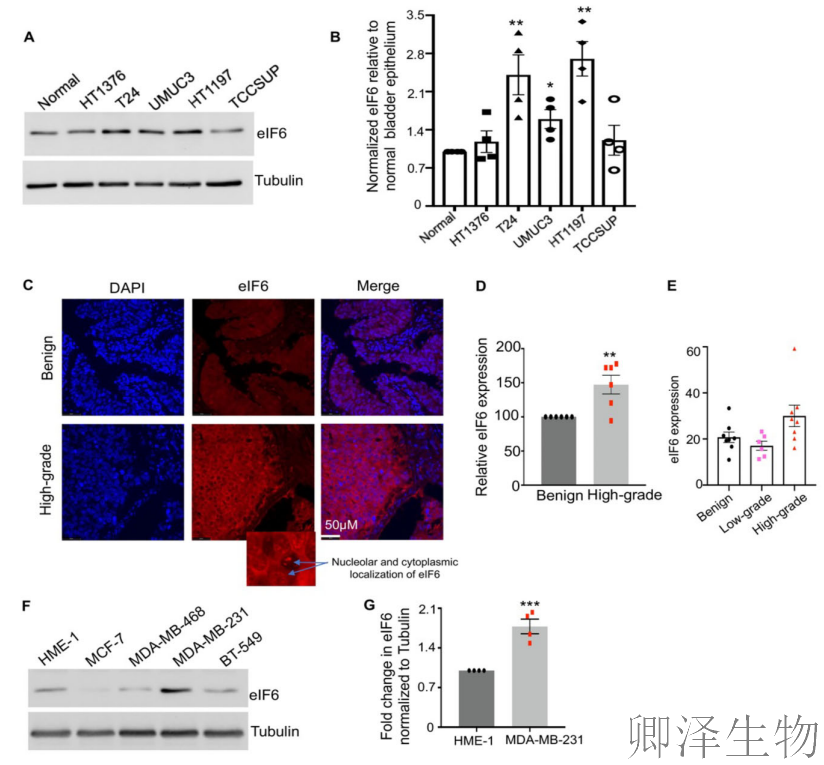
乳腺癌模型验证:eIF6表达仅在高度侵袭的三阴性乳腺癌细胞系MDA-MB-231中显著上调(图9F-G),其他亚型未见诱导,进一步印证其表达与癌症侵袭性的特异性关联。
研究结论
这项研究不仅深化了我们对蛋白质合成调控在癌症中作用的理解,还为开发新型抗癌疗法提供了新方向。针对eIF6的靶向治疗,未来可能成为阻止癌症恶性进展的有效策略,特别是在抑制癌症转移方面展现巨大潜力。
欢迎致电了解详情或咨询!
广州卿泽生物科技有限公司
地址:广州市黄埔区伴河路96号一栋三层321房
电话:18925086102(微信同号)
该研究的创新之处在于将基础细胞过程(蛋白质合成)与癌症的典型特征(不受控的分裂和侵袭)直接联系起来,为理解癌症生物学提供了全新视角。随着进一步研究的深入,我们有理由期待基于这些发现的新型治疗策略的出现。




