广州卿泽生物科技有限公司
6 年
手机商铺
- NaN
- 0.8999999999999999
- 1.9
- 0.8999999999999999
- 3.9
推荐产品
公司新闻/正文
【线粒体翻译】 |线粒体翻译之谜破解!TACO1如何疏通蛋白质合成“堵点”?
212 人阅读发布时间:2025-09-23 16:54
导读:
~~揭开线粒体翻译的“交通堵塞”之谜~~
在细胞能量工厂线粒体中,蛋白质合成依赖于一套独特的翻译系统。然而,当蛋白质序列中出现连续脯氨酸(如PP或PPP)时,线粒体核糖体(mitoribosome)会“卡顿”,导致翻译停滞。这种现象类似于细菌中的EF-P或真核细胞中的eIF5A介导的救援机制,但线粒体中的对应因子长期未知。

本研究首次揭示:TACO1(一个与神经退行性疾病Leigh综合征相关的蛋白)正是这一缺失的关键因子。它通过缓解多脯氨酸序列引起的核糖体停滞,确保线粒体呼吸链核心蛋白(如COX1和COX3)的高效合成。这一发现不仅解开了线粒体翻译的分子机制谜题,还为相关疾病的治疗提供了新靶点。
文章索引:
标题:The human mitochondrial translation factor TACO1 alleviates mitoribosome stalling at polyproline stretches.
发表期刊:Nucleic Acids Research.
发表时间:2024.09
作者团队:迈阿密大学米勒医学院神经内科 Antoni Barrientos团队
IF:13.1
DOI:10.1093/nar/gkae645.
研究结果
(1)由于COX1 mRNA的异常翻译,TACO1的缺失导致细胞色素c氧化酶缺乏。
为了研究TACO1在线粒体翻译中的作用,作者构建了敲除(KO)TACO1的HEK293T细胞系(TACO1-KO)。在野生型(WT)、TACO1-KO和 TACO1 回补的HEK293T细胞模型中,TACO1缺失显著降低了COX1和COX2蛋白的稳态水平(图1A),同时BN-PAGE分析显示线粒体呼吸链复合物IV(CIV)的组装严重受损,而复合物II水平未受影响,这直接导致了细胞色素c氧化酶功能缺陷(图1B)。代谢标记实验进一步揭示,TACO1-KO细胞中³⁵S-甲硫氨酸标记的新合成线粒体蛋白出现异常:COX1的合成率降至约10%,COX3也中度下降,并伴随多个截断多肽(以星号标示)的积累(图1C)。
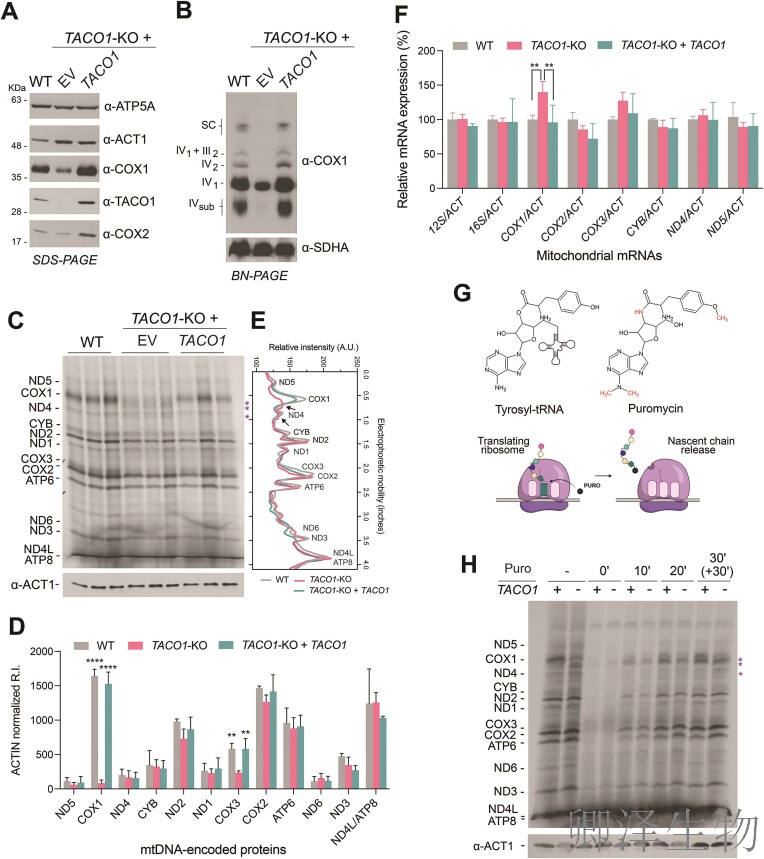
定量分析(图1D)显示COX1和COX3的合成显著减少,且分布图(图1E)突显了这些截断产物的特异性富集。值得注意的是,转录水平分析(图1F)表明COX1 mRNA丰度在TACO1-KO细胞中反而增加,这排除了转录缺陷的可能,并指向翻译延伸阶段的停滞。
为探究停滞机制,嘌呤霉素作用示意图(图1G)阐释了其作为酪氨酰tRNA类似物诱导新生链提前释放的原理;基于此,嘌呤霉素释放实验(图1H)证实,在TACO1-KO细胞中添加嘌呤霉素后,COX1的截断多肽(以星号标示)在脉冲标记初期(0'和10')即大量释放,而在WT细胞中仅短暂出现,这表明TACO1 缺失导致核糖体在COX1翻译过程中持续停滞,无法高效完成多肽链延伸。
综上,TACO1是线粒体翻译的关键调节因子,其缺失通过COX1 mRNA的异常翻译引发能量代谢危机。
(2)TACO1结合线粒体核糖体并通过缓解多脯氨酸诱导的停滞正调控翻译
随后,作者通过SILAC蛋白质组学(图2A)和BioID邻近标记(图2B)证实TACO1特异性结合线粒体核糖体大亚基(mtLSU),尤其富集于A位点邻近的L7/L12柄区域(如bL12m/mL66),并与OXA1L插入酶互作,提示其参与翻译延伸的分子定位。
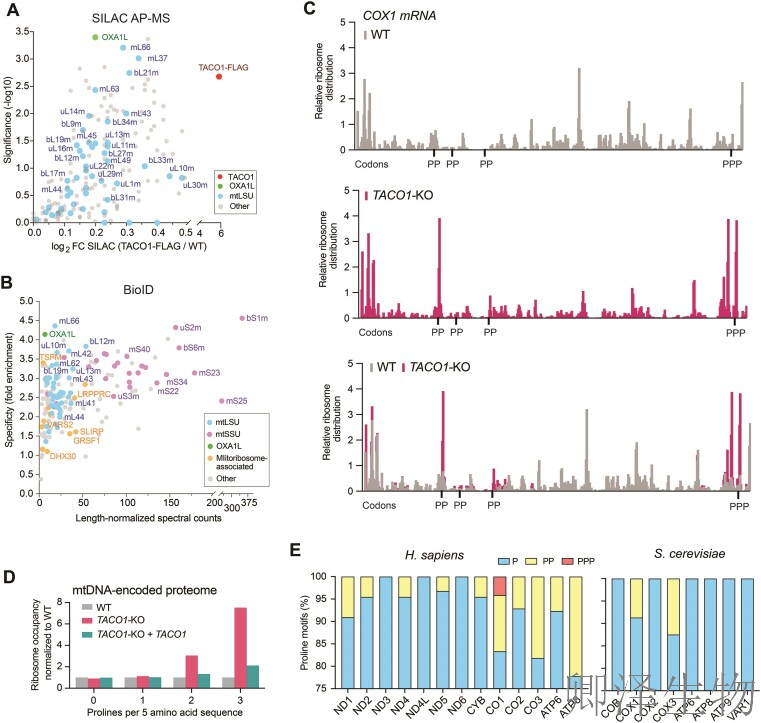
核糖体图谱分析(图2C)进一步揭示:TACO1缺失导致COX1 mRNA的核糖体在三个多脯氨酸基序(如第542位GCPPP)显著堆积,其中PPP基序停滞最强(红色峰值)。全局统计(图2D)显示TACO1对含≥2脯氨酸的序列(3脯氨酸区域占用率升高3.8倍)具有特异性救援功能。物种对比(图2E)指出人类线粒体蛋白含15个多脯氨酸基序(远超酵母的4个),且COX1独含PPP基序(红色箭头),从进化角度解释TACO1缺失在人类引发严重病理的必然性。
综上,TACO1通过结合mtLSU的翻译活性中心,选择性缓解多脯氨酸(尤其PPP基序)诱导的核糖体停滞,其功能是人类线粒体能量代谢维持的核心保障。
(3)在线粒体翻译过程中,TACO1和bL27m协同稳定PTC
最后,冷冻电镜结构(图3A)揭示bL27m(绿色)的N端结构域锚定于线粒体核糖体肽酰转移酶中心(PTC),直接稳定P位点tRNA(黑色)和新生链(橙色),为多脯氨酸翻译提供机械基础;代谢标记实验(图3B)显示TACO1缺失时,bL27m的N端突变(如S35A/S35F)进一步加剧翻译缺陷——COX1合成降至野生型(WT)的5%,且全局蛋白(如COX3、ND4)输出受损,而野生型bL27m表达可部分挽救表型;
密度定量分析(图3C)证实S35A突变使COX1合成显著降低(*P≤0.05),凸显bL27m S35残基作为功能枢纽;最终模型(图3D)阐释TACO1(红色)通过结合E位点,与bL27m形成“分子钳”稳定PTC构象,特异性解决多脯氨酸延伸的构象冲突(黄色箭头示意新生链延伸),这一协同机制为线粒体疾病治疗提供了靶向PTC的理论路径。
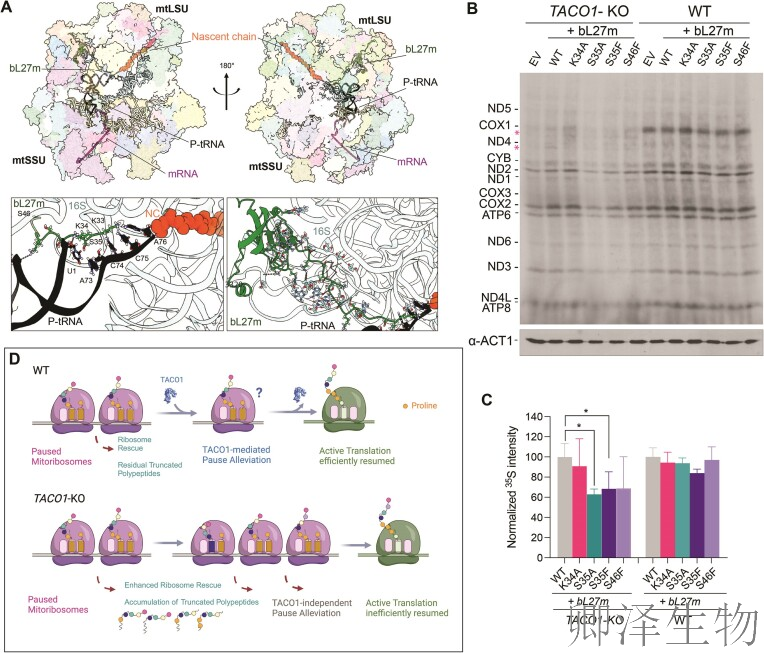
研究结论
本研究首次将TACO1定义为线粒体翻译延伸因子,革新了对其功能的认知:
•分子机制:TACO1通过结合mtLSU的E位点或邻近区域,稳定PTC和新生链构象,高效缓解多脯氨酸及部分非脯氨酸序列的核糖体停滞(类似细菌EF-P)。其与bL27m的协作是PTC功能的核心保障。
•生理意义:TACO1的缺失导致COX1/COX3合成障碍,进而引发呼吸链复合体IV(CIV)组装缺陷,这解释了TACO1突变相关Leigh综合征的病理基础——细胞能量危机。
•进化启示:人类线粒体蛋白的脯氨酸含量高于酵母,且COX1独含PPP基序,说明TACO1在高等生物中演化出更关键的适应性角色。
•应用前景:靶向TACO1或bL27m的稳定策略,可能为线粒体疾病提供新疗法。未来需通过冷冻电镜解析TACO1-核糖体复合物结构,以精确指导药物设计。
欢迎致电了解详情或咨询!
广州卿泽生物科技有限公司
地址:广州市黄埔区伴河路96号一栋三层321房
电话:18925086102(微信同号)




