广州卿泽生物科技有限公司
6 年
手机商铺
- NaN
- 0.8999999999999999
- 1.9
- 0.8999999999999999
- 3.9
推荐产品
公司新闻/正文
【核糖体碰撞-经典研究】 解密亨廷顿舞蹈症:核糖体碰撞如何引发神经元全局崩溃?
481 人阅读发布时间:2025-09-23 16:39
导读:
亨廷顿舞蹈症(HD)是一种致命的遗传性神经退行性疾病,由HTT基因中CAG重复序列异常扩展引发。患者大脑神经元逐渐死亡,导致运动失调、认知衰退。尽管已知突变蛋白(mHTT)会形成毒性聚集体,但具体致病机制始终成谜。
斯坦福大学团队在本研究中,首次揭示mHTT通过劫持翻译因子eIF5A引发全局性细胞崩溃的全新机制,为治疗带来新方向。
文章索引:
标题:Polyglutamine-mediated ribotoxicity disrupts proteostasis and stress responses in Huntington's disease.
发表期刊:Nature Cell Biology.
发表时间:2024.06
作者团队:美国斯坦福大学 Judith Frydman团队
IF:19.1
DOI:10.1038/s41556-024-01414-x.
研究结果
(1)uORF动态调节HTT转换
人类HTT mRNA含有一个uORF(图1a),且从小鼠到人类具有进化保守的(图1b)。众所周知,uORFs可以抑制下游ORFs的翻译。为了确定该uORF是否在体内抑制HTT翻译,作者分析了已有的Ribo-seq数据集。在用乳酸米多霉素(LTM)或三尖杉碱(Harr.)处理的培养的人细胞中,HTT mRNA的uORF和主ORF上都发现了起始核糖体(图1c)。在用CHX处理的细胞中,核糖体占据了uORF的整个长度(图1),这表明核糖体翻译uORF并在主要的HTT ORF之前终止。在小鼠海马和培养的原代神经元(图1d)也发现了类似的核糖体痕迹。
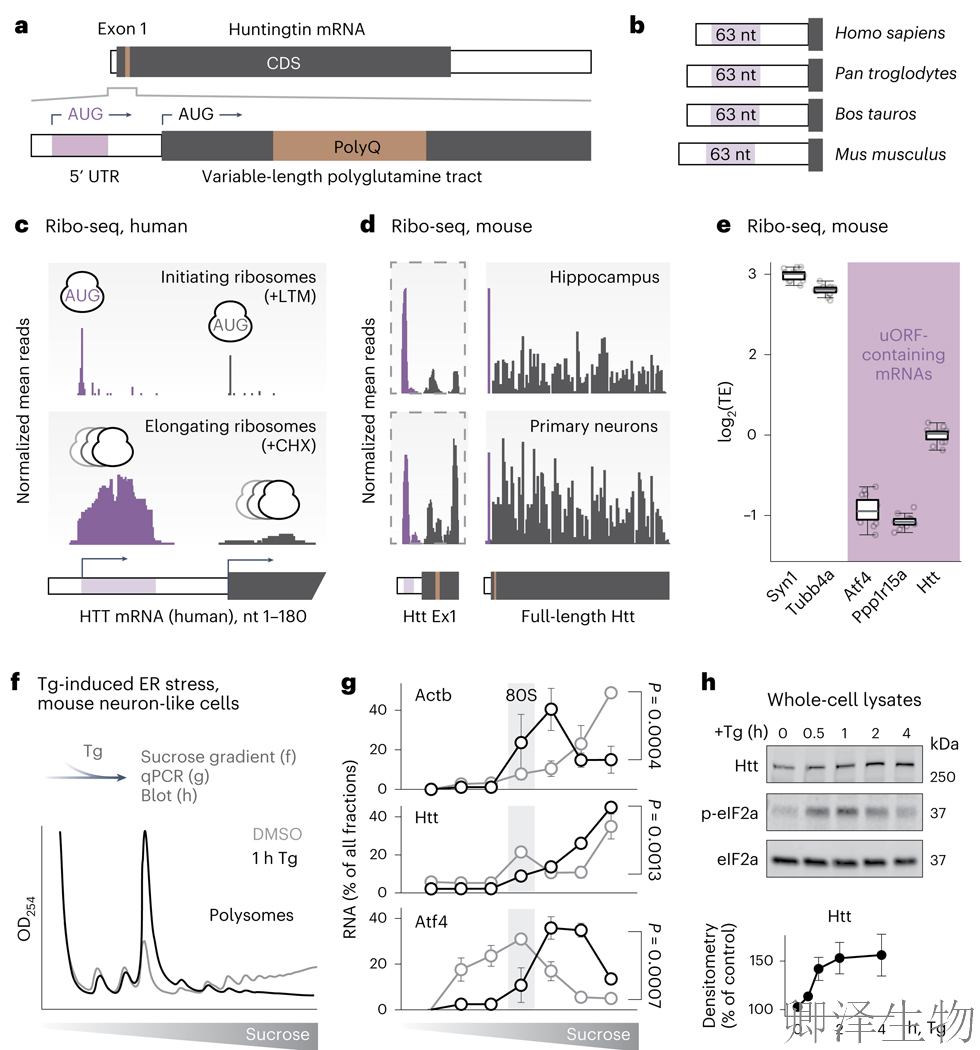
正常状态下uORF显著降低翻译效率(TE),小鼠海马体中HTT的TE值与已知uORF抑制蛋白ATF4、GADD34相当(图1e)。综上所述,内源性uORF通过减少主ORF上的起始量来抑制体内HTT的翻译。
已知uORF调控的转录本,在触发综合应激反应(ISR)的条件下增加其翻译。相应地,作者发现内质网应激剂Thapsigargin处理1小时后:多核糖体解离,Htt mRNA向重多核糖体迁移,且HTT蛋白表达量增加(图1f-h)。该发现解释了为何应激状态会加剧亨廷顿毒性蛋白聚集:uORF在应激时失去翻译抑制作用,导致突变HTT蛋白过量产生。
(2)uORF调节mHTT的聚集
由于HTT聚集是浓度依赖性的,作者接下来测试了HTT mRNA中功能性uORF的存在是否会影响编码蛋白的溶解度。
含完整uORF的HTT-ex1-GFP转染293T细胞40小时后,包涵体阳性细胞减少,uORF起始密码子突变(AUG→AAG)后则完全消除保护作用,说明uORF抑制包涵体形成(图a-c)。
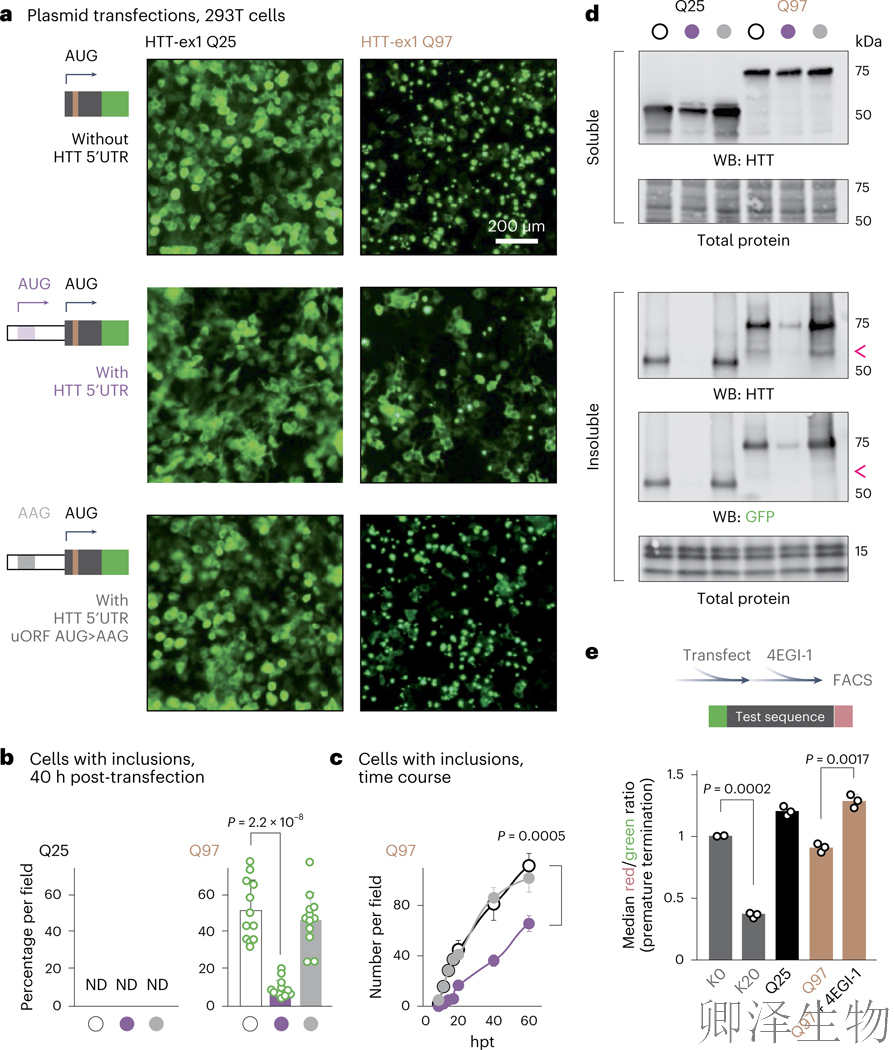
转染细胞的可溶性和不溶性部分的免疫印迹分析证实,uORF降低了293T和小鼠纹状体细胞中不溶性mHTT-ex1的比例(图2d)。为了测试mhttp -ex1的截断是否源于mhttp-ex1的过早翻译终止,作者使用了eIF4A1抑制剂--4EGI-1。发现与polyQ(25)相比,polyQ(97)的翻译会导致更高的流产终止率(图2e)。因此,无论是药理学还是通过其uORF,减弱mHTT-ex1翻译起始,都可以减少过早的翻译终止和易于聚集的片段的释放。
(3)mHTT上的核糖体碰撞导致翻译过早终止
随后,作者在脊髓灰质炎病毒载体系统(图3a)首次捕捉到polyQ扩展引发核糖体碰撞的动态过程,导致mHTT翻译异常终止与eIF5A耗竭。
为了监测HTT-ex1上的核糖体分布,作者用嘌呤霉素标记NCs,嘌呤霉素会被延长的核糖体共价结合,并且可以使用嘌呤霉素特异性抗体检测。如果核糖体在翻译的RNA上均匀分布,嘌呤霉素标记的NCs的大小也应均匀分布;相反,RNA特定区域上的核糖体局部积累将生成特定大小范围的嘌呤霉素标记的NCs。正如预测的那样,mHTT-ex1在Huh7中产生了强条的嘌呤霉素标记的核糖体 (图 3b),这表明局部核糖体积累;在RNase抗性实验中,polyQ(73)上形成了比polyQ(8)更多的RNase抗性三聚体(图3c)。重要的是,这些三聚体富集了特定于polyQ(73)的puromycylated NCs。
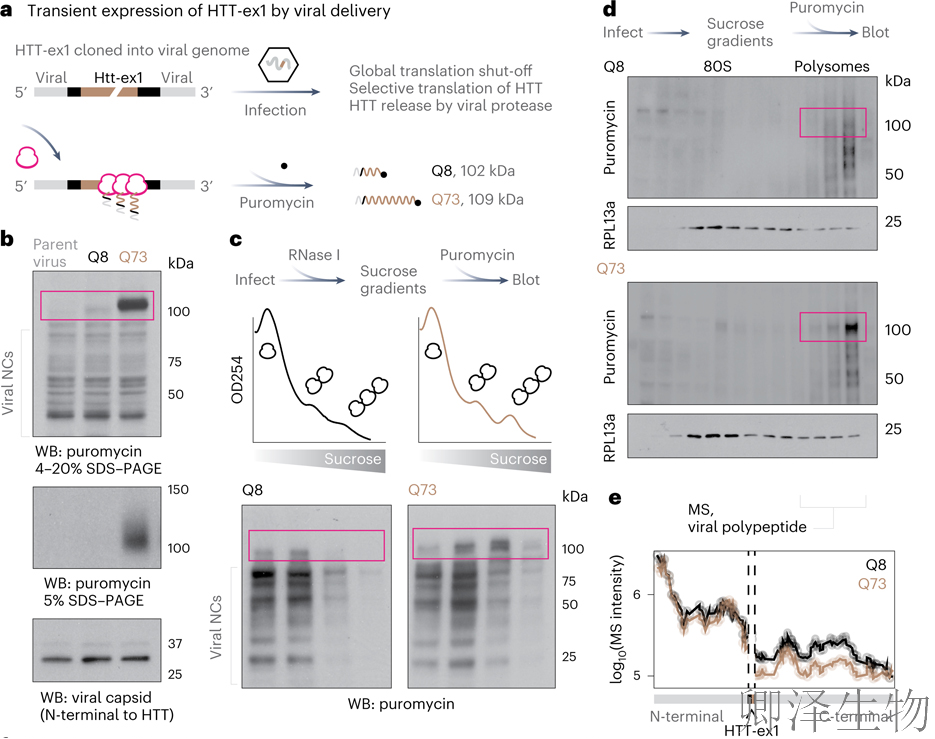
为了分离在mHTT-ex1上碰撞的核糖体,作者将裂解物在蔗糖梯度上进行离心分段,并使用嘌呤霉素标记NCs。基于嘌呤霉素免疫印迹(图3d),并通过LC-MS/MS分析发现:与polyQ(8)相比,polyQ(73)下游的病毒NCs较少,(图3e)。综上所述,HTT中的polyQ扩展增加了核糖体碰撞、异常终止以及释放易于聚集的mHTT片段的可能性。
(4)mHTT 消耗可溶性 eIF5A
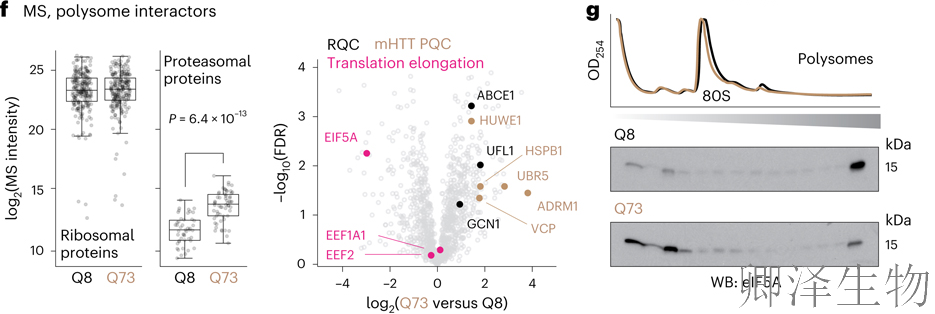
碰撞会招募核糖体质量控制(RQC)和蛋白质质量控制(PQC)因子,以促进翻译的解决和继续延伸,或提前终止和清除。为了确定polyQ(73)的翻译是否会吸引特定的RQC和PQC因子,作者比较了与翻译polyQ(73)或polyQ(8) HTT-ex1的多聚核糖体相互作用的蛋白质。结果发现,翻译polyQ(73) mHTT的核糖体会招募更多的RQC和PQC因子,包括更高水平的蛋白酶体;与碰撞相关的因子GCN1、ABCE1和UFL1;以及参与清除mHTT的PQC因子,包括UBR5、VCP/p97、HUWE1、ADRM1和HSPB1/Hsp27(图3f)。蔗糖梯度分析证实:polyQ(73)翻译时eIF5A从多核糖体解离(图3g)。
为了确定mHTT是否与eIF5A相互作用,作者用编码Htt-ex1-GFP变体的质粒转染293T细胞,然后进行GFP亲和纯化。与WT对照组相比,更多的eIF5A与polyQ(97) mHTT共纯化(图4a)。同样,在鼠N2a细胞43(图4b)和酵母中,更多的eIF5A与mHTT-ex1相互作用。最后,eIF5A也在表达mHTT-ex1的N2a细胞的不溶性部分中高度富集(图4c),这表明其与可溶性mHTT的相互作用导致聚集。
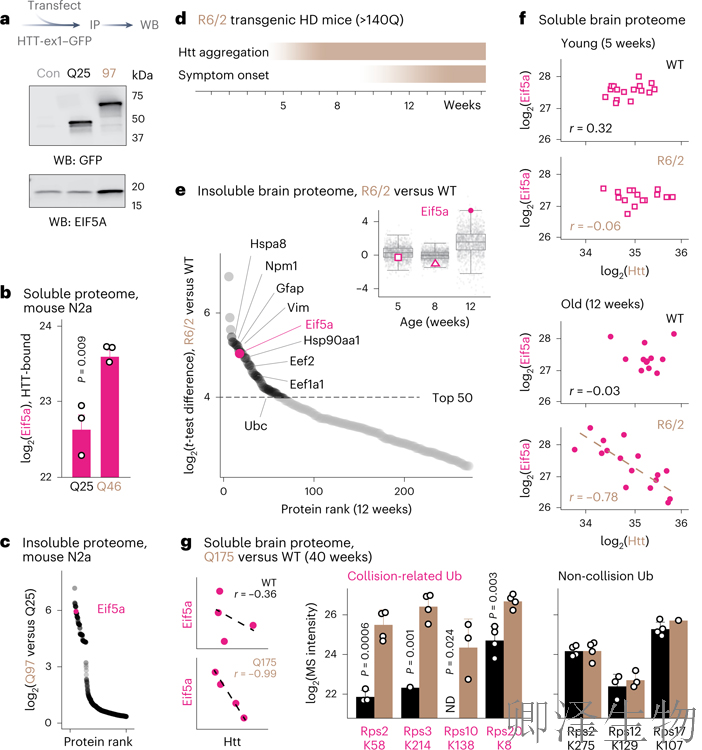
为了验证eIF5A耗竭与亨廷顿舞蹈症(HD)病程的因果关系,作者基于模型体系:R6/2(>140Q)与zQ175双小鼠模型脑蛋白组分析(图4d)发现:在亨廷顿病小鼠模型中,eIF5A在症状期脑组织不可溶组分中富集(图4e);可溶性eIF5A与mHtt蛋白呈负相关;早期存在代偿性升高(图4f);在zQ175模型中验证了类似现象(图4g)。
(5)eIF5A的缺失影响翻译延伸动力学
为了更清楚地定义eIF5A缺失对亨廷顿舞蹈症(HD)中翻译过程和细胞反应的影响,作者使用了来自表达两个拷贝全长Htt的小鼠的纹状体细胞,这些细胞分别含有polyQ(7)或polyQ(111)重复序列。
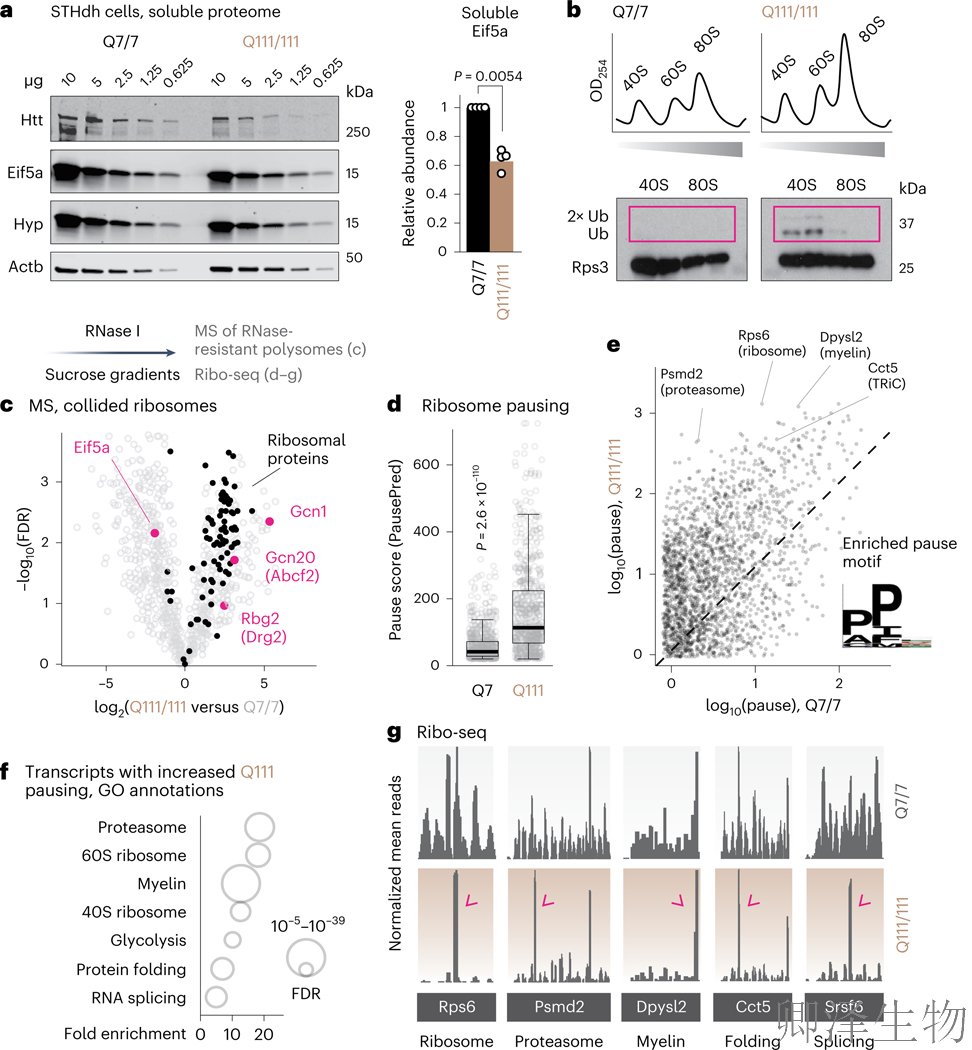
结果发现:mHtt表达导致可溶性eIF5A水平显著下降68%(图5a),同时触发40S核糖体蛋白泛素化增加2.3倍(核糖体碰撞标志事件,图5b)。经RNase I处理的抗性多核糖体分析显示,polyQ111细胞中碰撞复合体数量激增(图5c黑色柱),且该组分特异性耗竭eIF5A而富集碰撞识别复合体Gcn1-Gcn20-Rbg33(图5c粉色柱)。核糖体图谱分析进一步揭示:polyQ111细胞核糖体暂停率升高2.8倍(图5d),其中80%暂停事件富集于PPX三肽基序——这是已知依赖eIF5A穿越的困难序列(图5e)。这些暂停主要影响编码蛋白稳态关键因子的mRNA,包括核糖体蛋白、蛋白酶体亚基、分子伴侣TRiC/CCT及髓鞘形成相关因子(图5f-g),证实eIF5A耗竭通过破坏翻译延伸动力学,引发蛋白稳态全局崩溃的恶性循环。
(6)eIF5A的缺失会阻碍急性应激的恢复
HD中常见内质网应激和未折叠蛋白反应的激活,其调控可影响神经毒性。表达polyQ(111) mHTT的纹状体细胞对毒胡萝卜素(Tg)诱导的内质网应激敏感性显著升高3.1倍(图6a),其根源在于eIF5A缺失导致应激保护因子ATF4的翻译诱导受阻。尽管eIF2α磷酸化正常(应激响应启动标志),但核糖体异常滞留于ATF4的uORF区(扩展数据图6b),致使Tg刺激后ATF4蛋白累积延迟且峰值降低54%(图6b)。
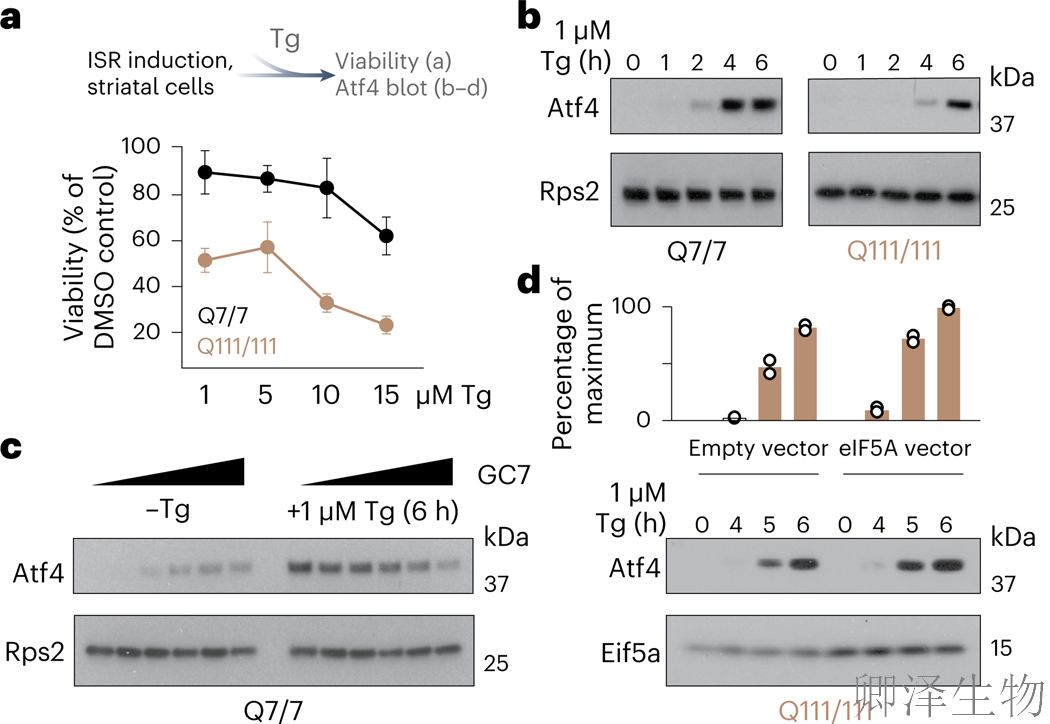
通过双向功能验证:1)在正常细胞中使用eIF5A抑制剂GC7,可剂量依赖性抑制ATF4应激诱导(降幅达41%)(图6c);2)在HD细胞中过表达eIF5A及其修饰酶Dhps,能部分恢复ATF4水平(提升2.3倍)(图6d)。这一发现证实eIF5A功能缺失是细胞丧失应激恢复能力的核心环节。基于此,通过药物干预减少eIF5A耗竭或增强其活性,有望成为HD治疗新策略。
(7)减少翻译起始可减轻HD的核毒性
若mHTT确实加剧细胞对核糖体碰撞的敏感性,则HD细胞应表现出双重药物反应特征:对促碰撞药物(通过减缓延伸诱发碰撞)高敏感,而对抑碰撞药物(通过减缓起始降低碰撞风险)低敏感。实验证实:polyQ(111)纹状体细胞对低剂量延伸抑制剂(如茴香霉素)的敏感性显著升高3.2-3.5倍(图7a),但对翻译起始抑制剂Rocaglamide A(RocA)和4EGI-1的敏感性降低38-41%(图7b)。进一步研究发现,polyQ(111)细胞自身通过降低基础翻译起始速率实现内源性保护:在转染含强停顿序列(K20)的双荧光报告系统后,其异常终止率比正常细胞低31%(p<0.01)(图7c)。
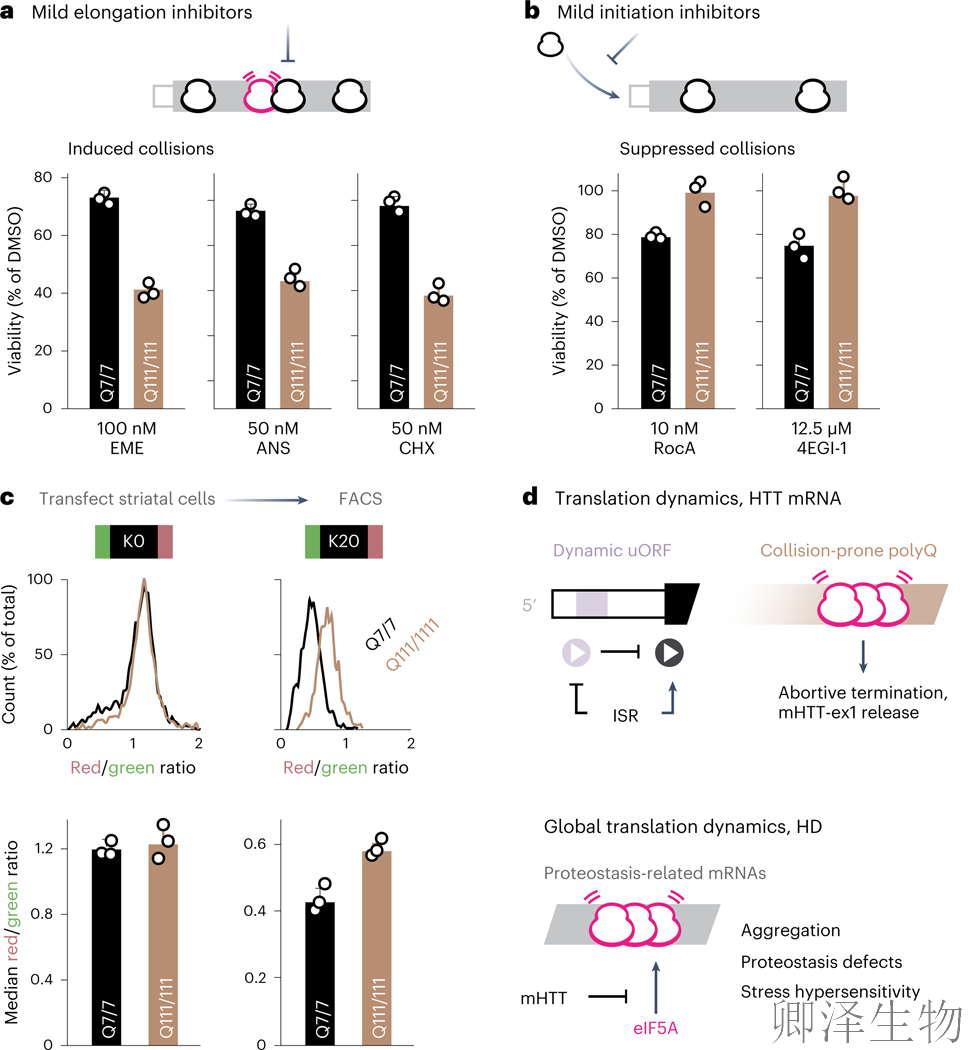
综上证实,降低翻译起始可通过减少核糖体密度来降低碰撞风险,从而缓解核糖体毒性应激与异常终止,为HD治疗提供新靶点。
研究结论
这项研究揭示出:野生型HTT和mHTT的翻译和聚集都受到一个应激反应上游开放阅读框的调控,并且polyQ扩展导致翻译终止失败并释放出易于聚集的截短mHTT片段。值得注意的是,mHTT在有症状的HD小鼠和培养的HD细胞的脑中耗尽翻译延长因子eIF5A,导致广泛的核糖体暂停和碰撞。eIF5A的缺失破坏了稳态控制并影响急性压力后的恢复。重要的是,抑制翻译起始的药物减少过早终止,并减轻HD中这种不断升级的核糖毒性压力和功能障碍。
欢迎致电了解详情或咨询!
广州卿泽生物科技有限公司
地址:广州市黄埔区伴河路96号一栋三层321房
电话:18925086102(微信同号)



