广州卿泽生物科技有限公司
6 年
手机商铺
- NaN
- 0.8999999999999999
- 1.9
- 0.8999999999999999
- 3.9
推荐产品
公司新闻/正文
【核糖体组装因子】 | 核糖体"质检员"Reh1工作到第一轮翻译才下岗
63 人阅读发布时间:2025-10-30 15:23
导读:
功能核糖体亚基的组装并成功地将它们传递到翻译库是蛋白质合成和细胞生长的先决条件。传统观点认为核糖体在组装完成后即具备完整功能,

但本研究揭示,在酵母细胞中,核糖体组装因子Reh1会持续"驻守"在新生60S亚基上,直至其完成第一轮翻译才被新生肽链"挤走"。这一发现重塑了我们对核糖体成熟过程的认知,揭示了质量控制的环节!
文章索引:
标题:The assembly factor Reh1 is released from the ribosome during its initial round of translation.
发表期刊:Nature Communications.
发表时间:2025.02
作者团队:美国德克萨斯大学 Arlen W. Johnson团队
IF:15.7
DOI:10.1038/s41467-025-55844-8.
研究概览:
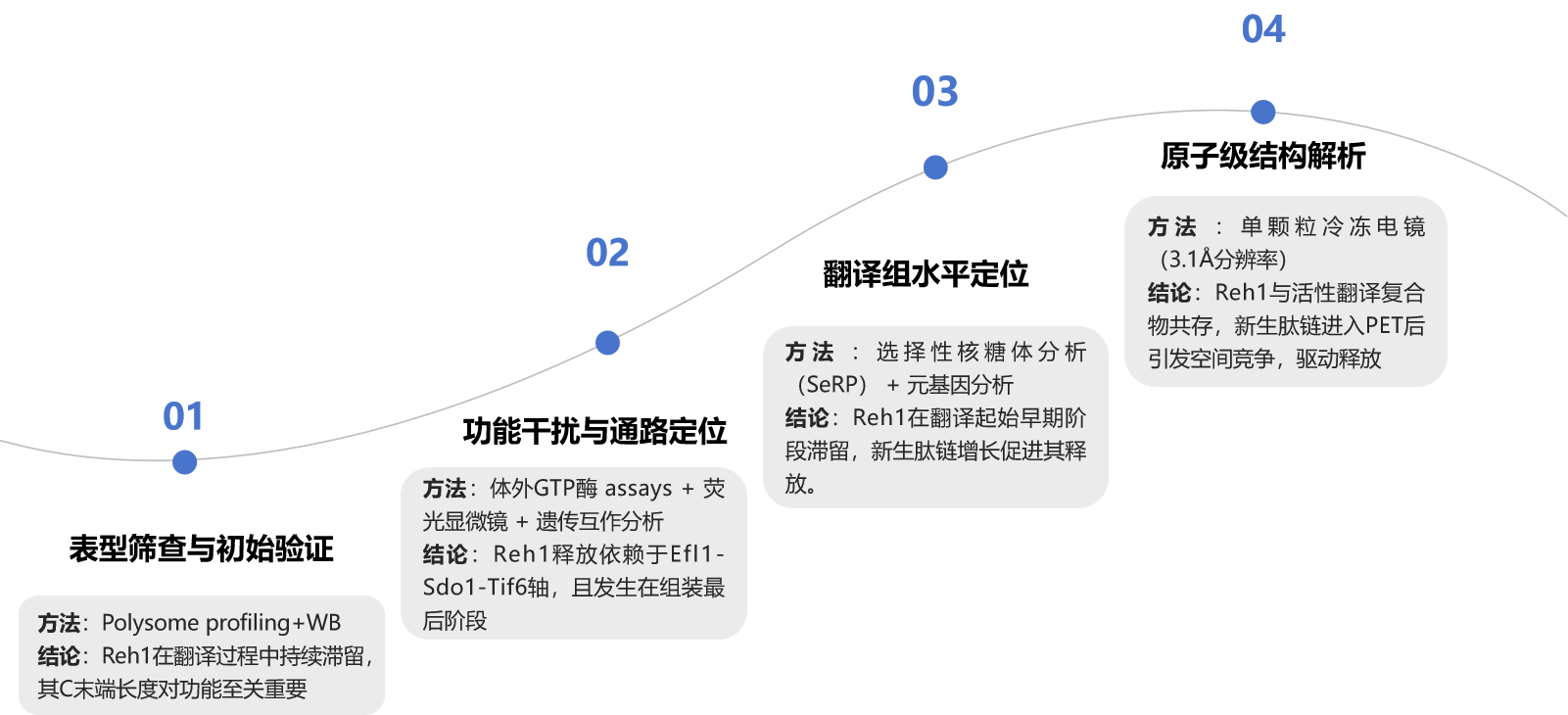
研究结果
(1)Reh1全程护航核糖体,直到完成"首轮翻译"才卸任
首先,作者通过polysome profling分析发现Reh1(3 x myc标签)不仅存在于自由60S亚基中,更显著出现在多核糖体区域(图1b)。这一反常现象提示Reh1可能伴随核糖体进入了翻译过程。
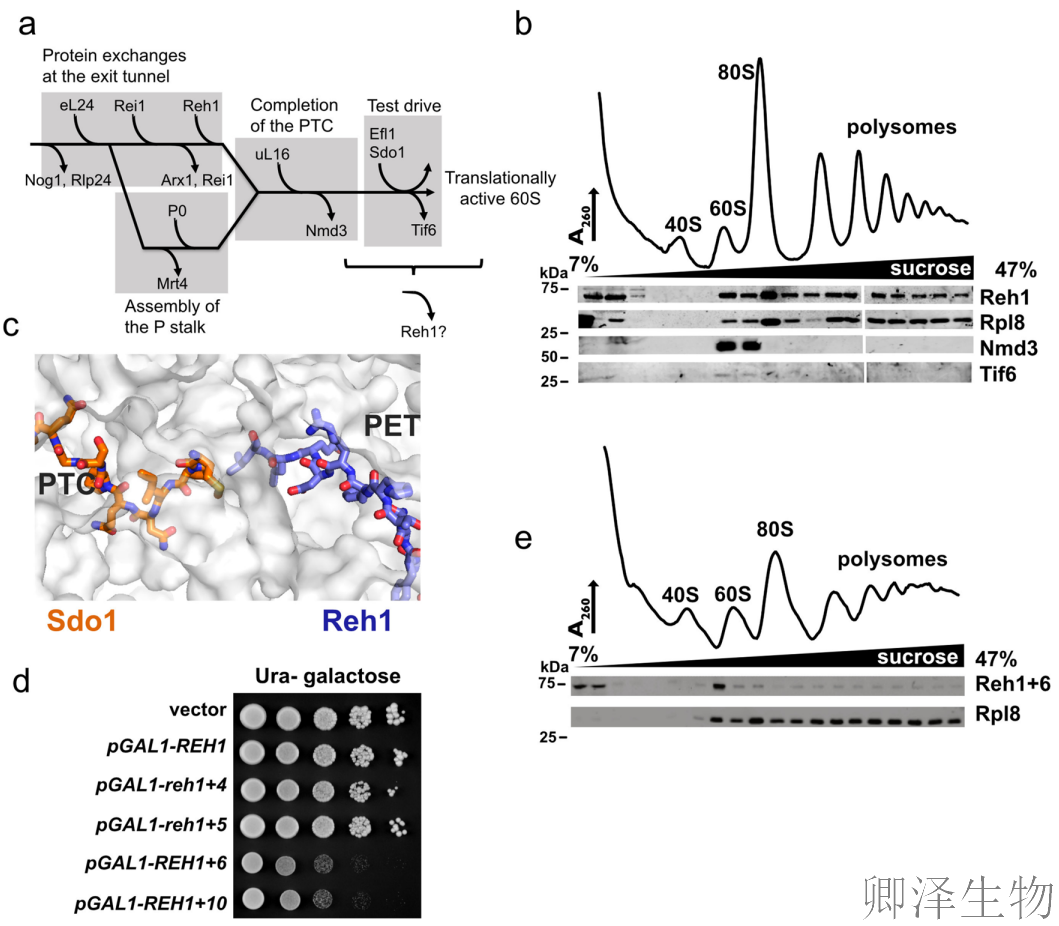
分子模型显示,Reh1的C末端深入核糖体的肽链出口通道(PET),其空间构型与关键因子Sdo1的N末端存在竞争关系(图1c),暗示Reh1可能通过物理占位阻碍新生肽链的延伸,从而滞留于核糖体。
为验证这一机制,作者构建了Reh1-Sdo1融合突变体(REH1+6)。令人惊讶的是,该突变体表现出强烈的显性负效应(图1d),显著抑制酵母生长,说明其干扰了正常功能。Polysome profiling实验证实,REH1+6突变体无法进入多核糖体,仅滞留于pre-60S区域(图1e),表明Reh1是通过生物发生途径(而非回收途径)结合核糖体,且其C末端长度对功能发挥至关重要。
这些结果共同表明,Reh1是一个被发现在核糖体首轮翻译中仍"驻守"的组装因子。其释放并非在组装完成后立即发生,而是需由新生肽链延伸至一定长度后触发物理排斥才实现。该发现彻底颠覆了"核糖体组装与功能激活完全分离"的传统认知,揭示了生物质量控制的全新维度。
(2)Reh1+6突变体如何阻断核糖体成熟关键步骤
随后,作者通过多维度实验揭示:Reh1 C末端融合Sdo1的6个氨基酸(Reh1+6)通过抑制GTP酶Efl1的功能,特异性阻断60S核糖体亚基的晚期成熟过程,导致翻译起始缺陷。
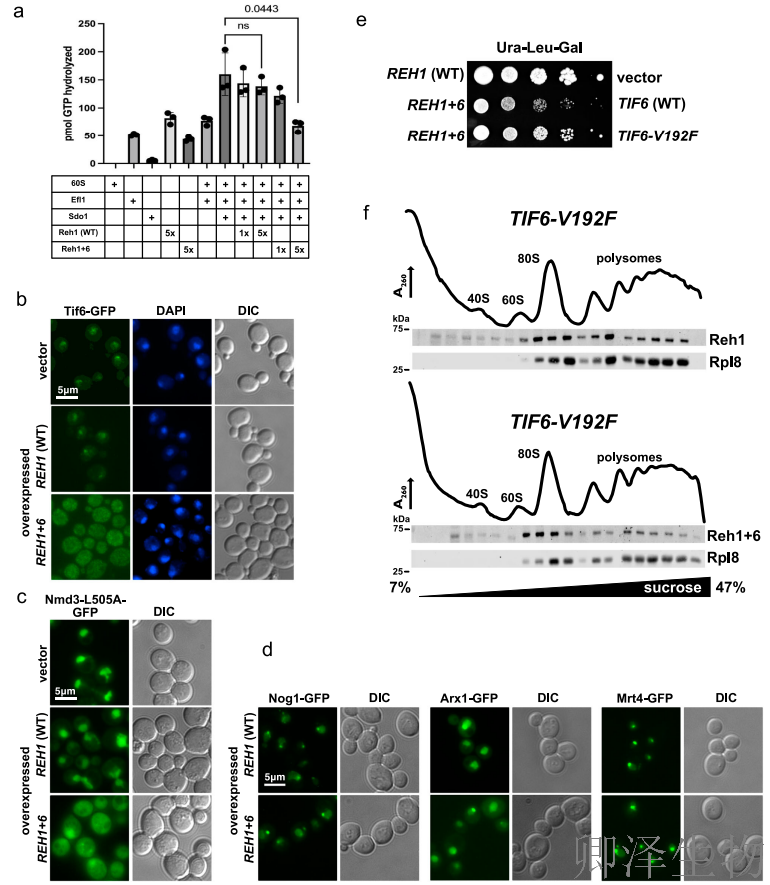
体外GTP酶实验(图2a)显示,Reh1+6以剂量依赖性方式抑制Efl1的GTP水解活性,而野生型Reh1无此效应,表明突变体直接干扰了Efl1-Sdo1-60S复合物的功能。荧光显微镜观察发现,Reh1+6表达显著抑制Tif6-GFP和Nmd3-L505A-GFP的核质回收(图2b-c),但上游因子Nog1、Mrt4、Arx1的回收不受影响(图2d),证明Reh1+6特异性靶向晚期成熟节点。
遗传互作实验表明,TIF6功能获得性突变(V192F)可完全抑制Reh1+6的显性负生长缺陷,且Polysome profling分析证实:在TIF6-V192F背景下,Reh1+6突变体首次进入多核糖体区(图2e-f),说明Tif6释放是Reh1解离的前提。
综上,Reh1+6通过“冻结”Efl1介导的Tif6释放步骤,将60S亚基阻滞在翻译前状态,揭示了核糖体成熟最终环节的精密调控逻辑——Reh1的释放不仅依赖肽链驱逐,更需Efl1-GTPase的正常激活。
(3)Reh1结合的核糖体富集于起始密码子区域,揭示其翻译起始监管角色
上述结果表明,在亚基结合进行翻译起始后,Reh1仍与新生的60S亚基保持关联。为了更全面地了解Reh1在翻译循环中何时被释放,作者采用选择性核糖体谱分析技术,结果揭示出:Reh1特异性结合的核糖体在mRNA翻译起始阶段高度富集,表明其作为组装因子持续监控核糖体的"首轮翻译"过程。
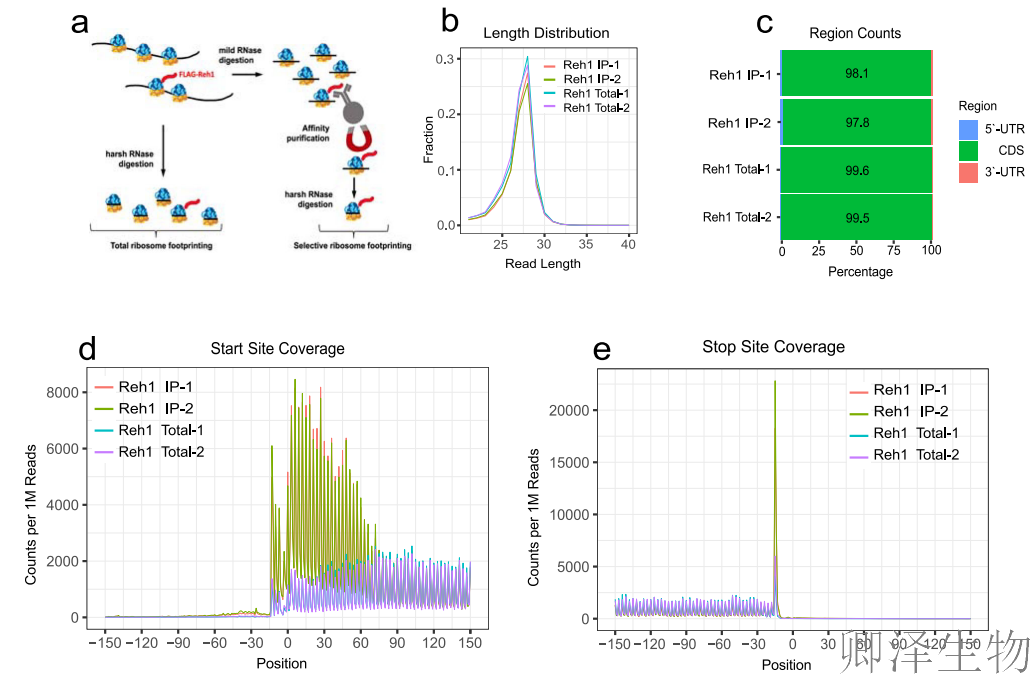
选择性核糖体分析(SeRP)流程(图3a)显示,Reh1免疫沉淀捕获的核糖体足迹读长集中于28 nt(图3b),且>97%的读段映射到编码序列(CDS),而非UTR区域(图3c),证实Reh1结合的是活跃翻译的核糖体。
元基因分析揭示,Reh1结合核糖体在起始密码子附近(-50至+50 nt)呈现显著富集峰(图3d),而终止密码子处也有次级信号(图3e)。

量化分析显示,Reh1结合核糖体的读段在起始密码子后25个密码子内密度最高(图3f,蓝色柱状),与总核糖体(粉色)的均匀分布形成鲜明对比,表明Reh1在翻译早期阶段滞留。Reh1∆6突变体(C端缺失6个氨基酸)的足迹显示,读段富集区域向编码序列内部延伸(图3g),表明缩短的C末端允许新生肽链更久地耐受Reh1占用出口隧道,进一步支持"肽链驱逐"模型——Reh1的释放由新生肽链长度触发。
因此,Reh1作为核糖体组装的质量控制"哨兵",持续驻留直至起始翻译完成,其释放动力学受C末端与肽链的物理相互作用调控。这一发现为核糖体功能激活提供了时空分辨率的新见解。
(4)冷冻电镜揭示Reh1如何"驻守"活性核糖体
接着,作者通过3.1Å分辨率的冷冻电镜结构,首次在原子层面揭示了Reh1与正在翻译的80S核糖体的精确相互作用,为"肽链驱逐模型"提供了直接结构证据。
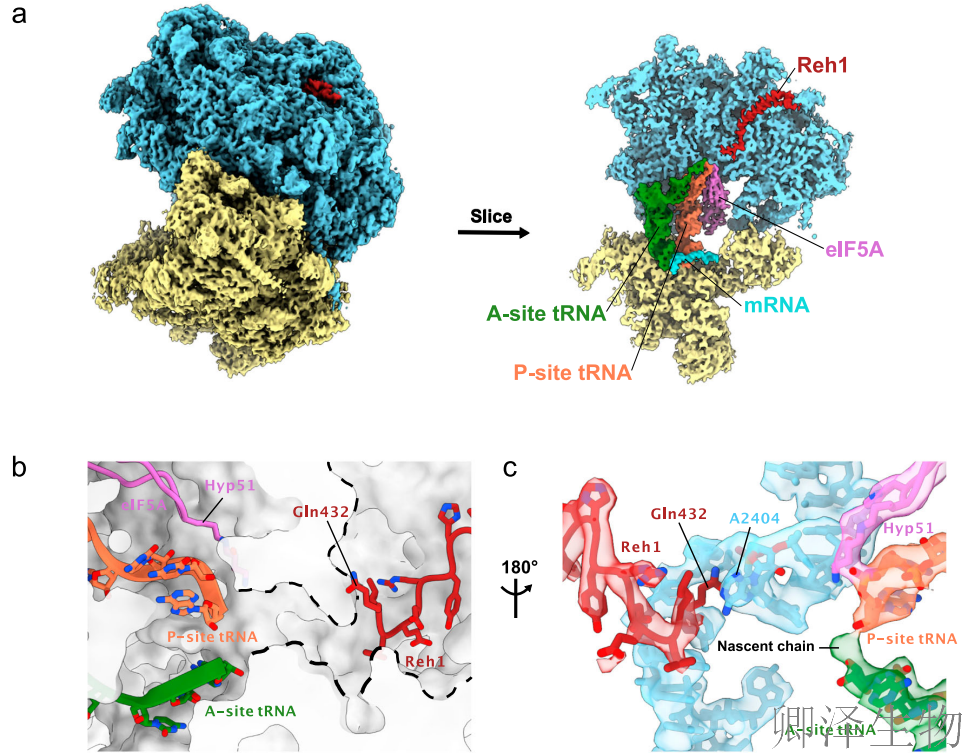
冷冻电镜结构不仅直观证实了Reh1在活性翻译复合物中的存在,更揭示了其通过特异性分子相互作用"监控"核糖体功能状态的精细机制。Reh1的C末端在PET内的精确定位,为理解"新生肽链如何触发组装因子释放"这一基本生物学问题提供了原子级别的结构框架。
研究结论
这项研究颠覆了"核糖体组装与翻译功能激活完全分离"的传统认知,揭示:
l Reh1是已知的伴随核糖体进入首轮翻译的组装因子
l 核糖体功能成熟是一个延续至首次翻译的动态过程
l 肽链出口通道的"清空"需要主动驱逐机制
Reh1如同核糖体的"出厂质检员",必须亲眼见证首轮翻译顺利完成才肯"下岗",这一精密机制确保了蛋白质合成机器的可靠性,为生命过程的精细调控提供了全新范例。
欢迎致电了解详情或咨询!
广州卿泽生物科技有限公司
地址:广州市黄埔区伴河路96号一栋三层321房
电话:18925086102(微信同号)




