广州卿泽生物科技有限公司
6 年
手机商铺
- NaN
- 0.8999999999999999
- 1.9
- 0.8999999999999999
- 3.9
推荐产品
公司新闻/正文
【核糖体碰撞-经典研究】 颠覆认知!免疫系统的“分子刹车”:抗病毒蛋白如何瘫痪病毒工厂
242 人阅读发布时间:2025-09-23 14:30
导读:
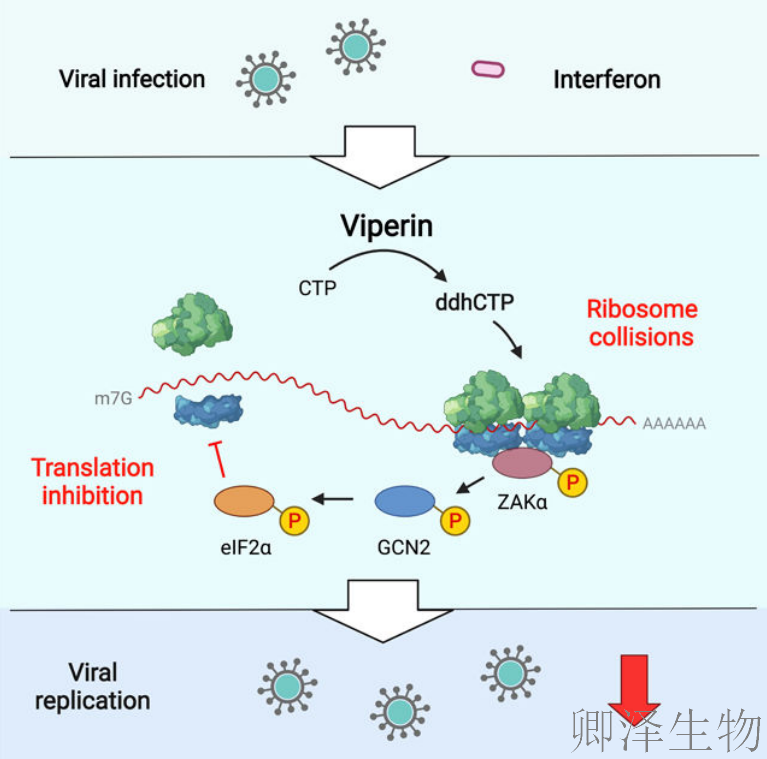
Viperin作为一种神秘的抗病毒蛋白,能抑制艾滋病毒、寨卡病毒、登革热等数十种致命病毒,却无人知晓其工作原理。

本研究发现:Viperin竟能触发细胞内的“交通事故”,让病毒复制机器集体抛锚!这一发现为开发广谱抗病毒药物开辟全新路径。
文章索引:
标题:Viperin triggers ribosome collision-dependent translation inhibition to restrict viral replication.
发表期刊:Molecular Cell.
发表时间:2022.05
作者团队:耶鲁大学医学院免疫生物系 Peter Cresswell团队
IF:16.6
DOI:10.1016/j.molcel.2022.02.031.
研究结果
(1)Viperin抑制病毒翻译
为了测试viperin在病毒复制中的作用,作者构建了一个稳定的293T细胞系,表达Dox诱导的viperin (293T. iVip)(图1A)。viperin显著抑制病毒滴度(图1B),病毒"外壳"E蛋白合成骤减(图1C)。但病毒RNA仅均匀减少(图1D)。
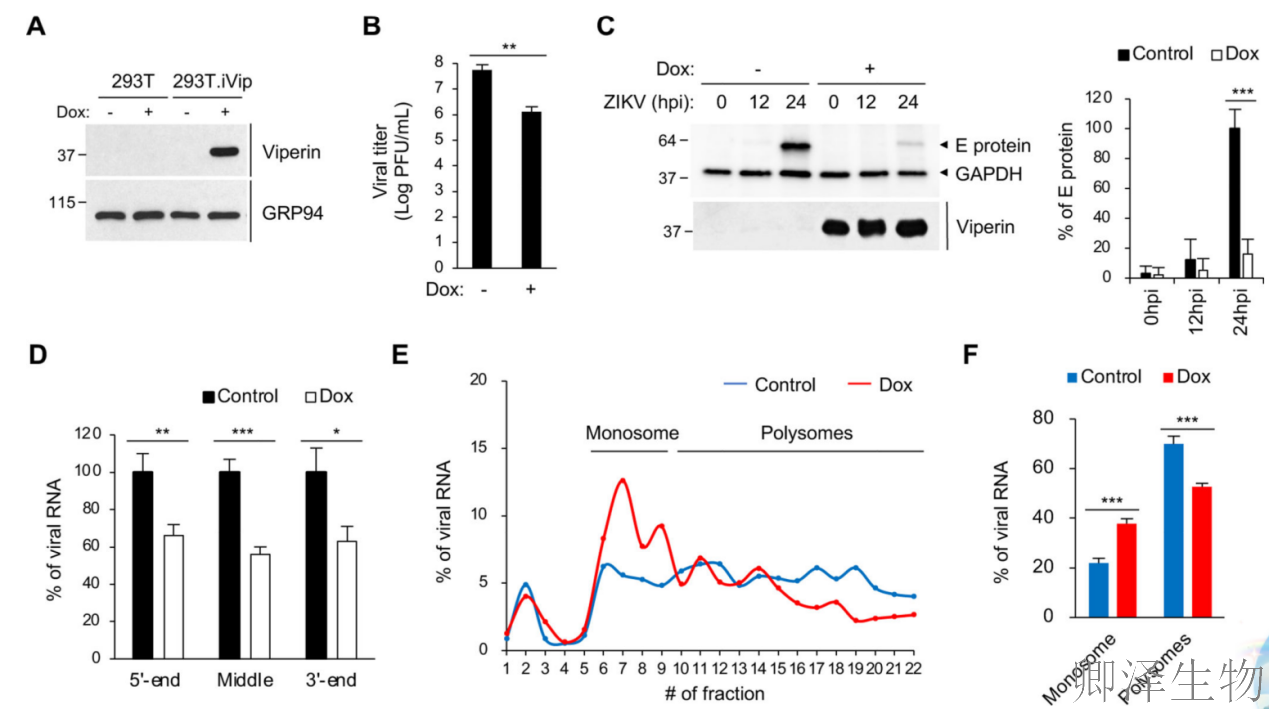
病毒RNA和蛋白质水平之间的不平衡表明,viperin可能影响病毒RNA的翻译。为了研究这个问题,作者进行了Polysome分析与qRT-PCR分析,直接监测翻译效率。viperin的表达导致病毒RNA分布从主动翻译多体到单体的剧烈转变(图1E-F)。这表明viperin抑制了ZIKV病毒RNA的翻译。
(2)Viperin在I型干扰素反应中抑制宿主翻译
鉴于viperin具有广泛的抗病毒活性,作者推测viperin可能通过抑制整体翻译而非特异性抑制病毒RNA的翻译来发挥作用。Polysome技术揭示出viperin会引起全局翻译停滞(图2A-B)。
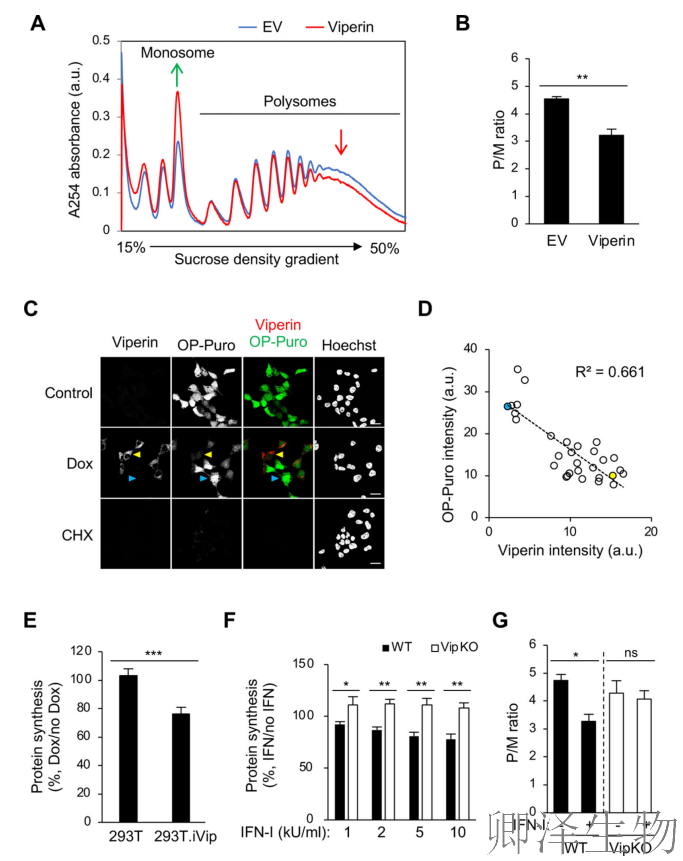
O-炔丙基嘌呤霉素(OP-Puro)标记实验显示:高表达Viperin的细胞蛋白合成量骤减,远高于低表达细胞(图2C)。量化证实:Viperin表达量与蛋白合成强负相关(R²=0.66)(图2D)。流式细胞术显示viperin的诱导抑制了细胞蛋白质合成约30%(图2E)。
Viperin主要在IFN刺激或病毒感染的细胞中表达。使用OP-Puro标记发现IFN-I刺激以剂量依赖的方式减少了WT 巨噬细胞(iBMDM)中的蛋白质合成,而在VipKO-iBMDM中没有发现减少(图2F-G)。Polysome分析也证实了这一点。这说明数百种干扰素诱导基因中,Viperin是一翻译抑制开关!
(3)抗病毒蛋白的“致命漏洞”被发现!
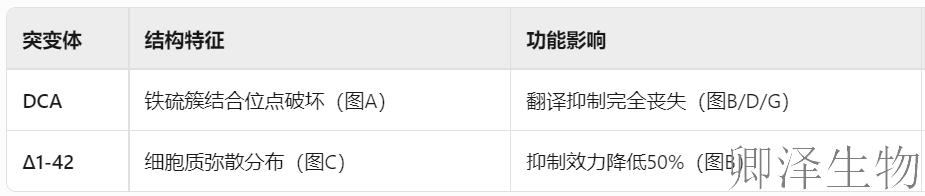
接下来,作者使用突变分析来确定Viperin中负责翻译抑制的关键区域,比如自由基SAM活性。Viperin含有由三个半胱氨酸残基协调的典型所需的[4Fe-4S]簇,将其中两个突变为丙氨酸(DCA,图3A)会导致翻译抑制丧失(图3B)。而如果缺失N端1-42氨基酸的突变体(Δ1-42),虽保留细胞质定位(图3C),但翻译抑制效力减半(图3B)。这些结果通过使用[35S]-蛋氨酸/半胱氨酸代谢标记监测新合成的蛋白质得到证实(图3D)。
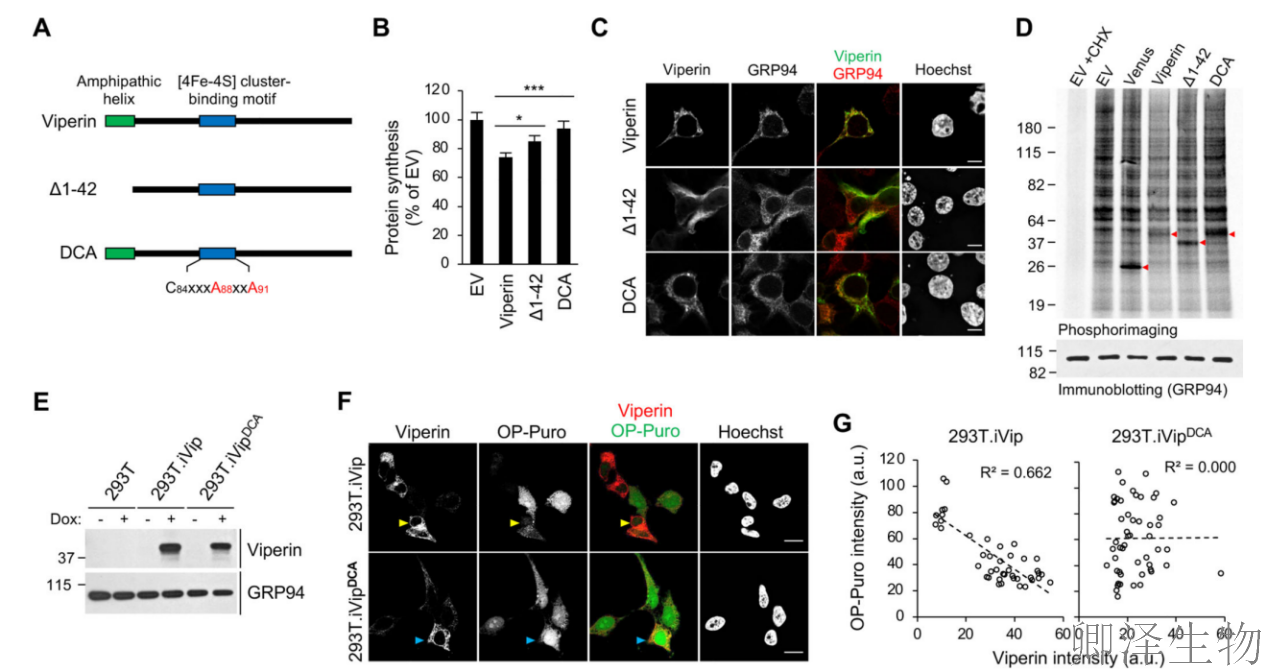
为了进一步研究自由基SAM活性的作用,作者构建了一个Dox诱导的表达DCA突变体的293T细胞衍生物(293T. iVipDCA)(图3E)。一致地,诱导WT viperin引起翻译抑制,而诱导DCA突变体则没有(图3F)。
(4)Viperin产物ddhCTP抑制翻译
已知ddhCTP的合成归因于viperin的自由基SAM酶活性(图4A)。同样的,在可诱导的293T细胞中,野生型viperin(而非酶活性缺失的DCA突变体)能够诱导ddhCTP的合成(图4B)。
为了确定ddhCTP是否直接抑制翻译,作者用合成的ddhC核苷处理细胞,该核苷穿过质膜并在细胞质溶胶中转化为ddhCTP。OP-Puro标记发现ddhC处理导致翻译显著减少(图4C)。同时,在多种细胞中进行了ddhC处理和OP-Puro标记分析。观察到ddhC处理抑制了人细胞系(293T和HeLa细胞)、猴成纤维细胞(Vero细胞)和小鼠iBMDM的翻译(图4D-E)。
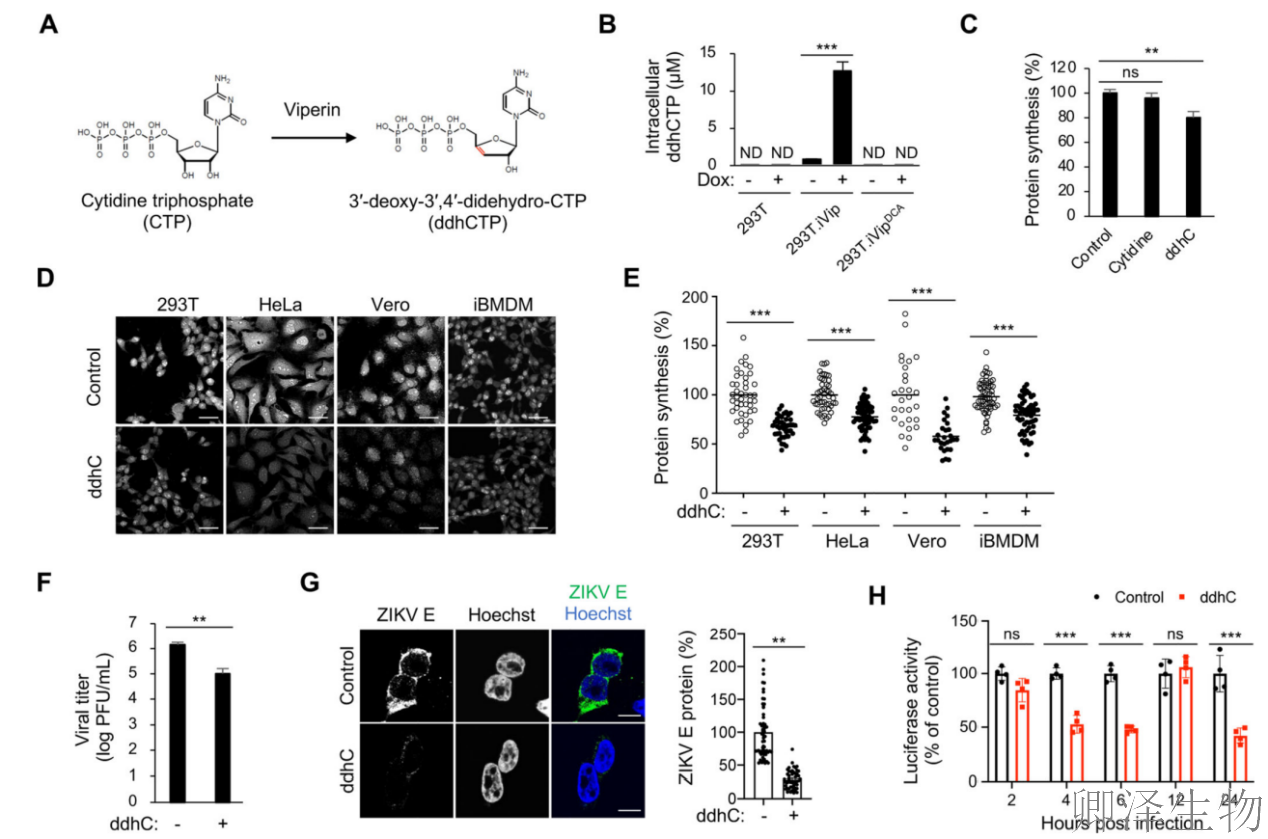
接着,作者评估了ddhCTP的翻译抑制对viperin抗病毒活性的影响。合成ddhC显著抑制ZIKV复制(图4F)。值得注意的是,在ddhC处理的细胞中,病毒蛋白合成显著减少(图4G)。利用荧光素酶报告基因ZIKV,发现ddhC在初始翻译(4和6 hpi)和病毒复制后期(24 hpi)显著抑制ZIKV蛋白合成(图4H)。
总的来说,研究结果表明,viperin通过其酶产物ddhCTP抑制细胞和病毒的RNA翻译。
(5)Viperin激活了综合应激反应
前文中已知viperin可抑制全局翻译。考虑到IFN-I反应通过综合应激反应(ISR)和mTORC1途径下调全局翻译,作者因此研究了viperin在激活293T.iVip中这些途径的分子成分中的作用。
首先,发现viperin诱导eIF2α磷酸化,这是ISR通路激活的标志(图5A)。Dox诱导后3小时,当viperin首次被检测到时,磷酸化是明显的,并在12-24小时达到峰值(图5B)。此外,发现合成的ddhC核苷以剂量依赖性的方式增加了eIF2α的磷酸化(图5C)。
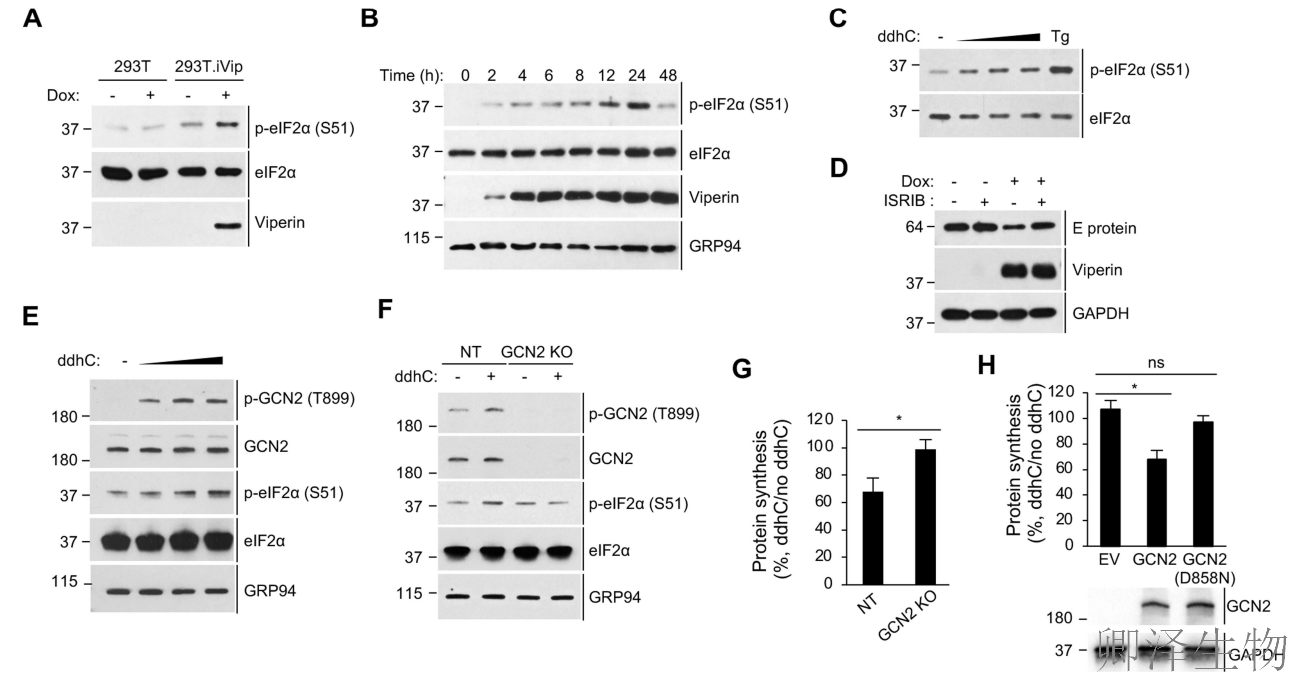
鉴于viperin对ISR的激活,那这条通路是否参与了病毒蛋白合成的抑制?viperin的表达抑制ZIKV蛋白的合成(图5D),但这被用ISRIB(ISR抑制剂)所消除。这些结果表明,viperin激活ISR,导致翻译抑制,作为抗病毒机制。
ISR的激活会抑制各种细胞应激下的细胞翻译。四种eIF2α激酶,GCN2, PKR, PERK和HRI,作为检测不同细胞应激的传感器。作者发现ddhC以剂量依赖性的方式诱导GCN2的磷酸化,但对其他激酶没有影响(图5E)。GCN2敲除细胞中,ddhC既不能磷酸化eIF2α(图5F),也无法抑制翻译(图5G)。激酶死亡突变体(GCN2-D858N)也丧失功能救援能力(图5H)。这些观察结果支持GCN2在viperin激活ISR中的核心作用。
(6)Viperin 引发核糖体碰撞从而激活 ISR
研究表明核糖体碰撞会激活ISR通路中的GCN2。那viperin是否通过诱导核糖体碰撞来激活GCN2?
核糖体碰撞可以通过多聚核糖体图谱中disomes的积累直接监测。在表达viperin的细胞中,有一部分核糖体确实能抵抗RNase消化,并以二聚体形式沉淀下来(图6A)。
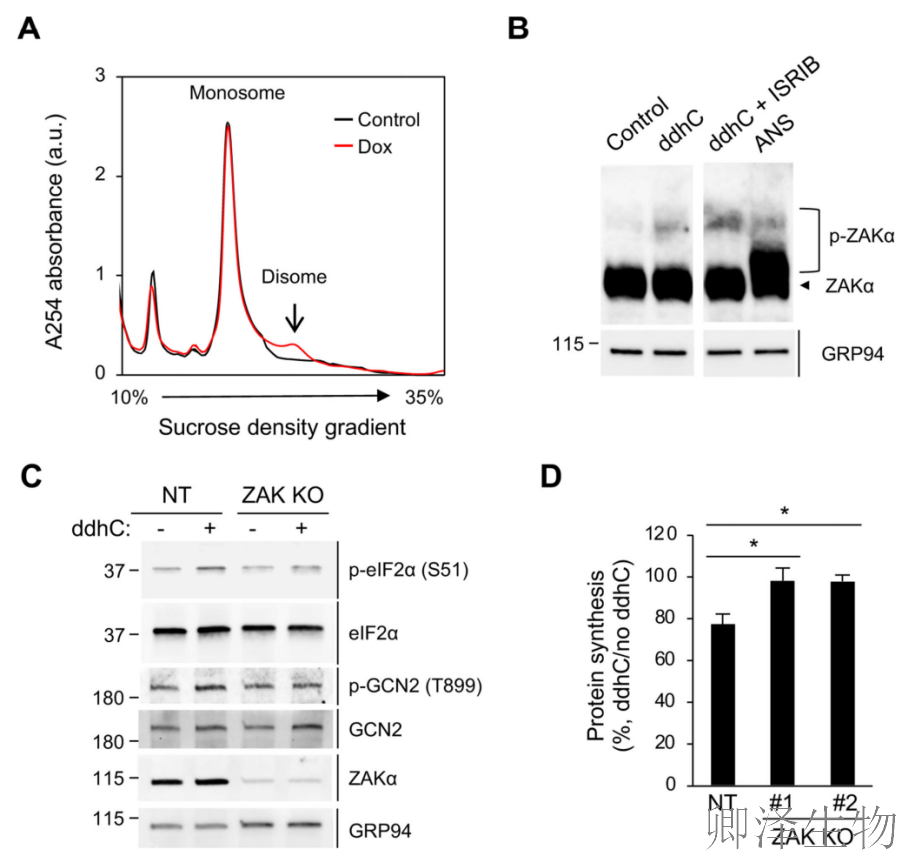
MAPKKK ZAK是一种碰撞核糖体的传感器。作者将核糖体碰撞与GCN2-ISR途径联系起来,并表明碰撞激活了ZAKα亚型的磷酸化(ZAKα)。合成的ddhC核苷酸诱导ZAKα磷酸化,而且该效应被ISRIB增强(图6B)。为了确定ddhC激活ISR是否需要ZAKα,作者构建了ZAK KO 293T细胞系。ddhC处理在对照细胞中诱导了eIF2α和GCN2的磷酸化(图6C),而在ZAK KO细胞中没有观察到这种变化(图6C)。此外,与ZAK在连接viperin诱导的核糖体碰撞和翻译抑制中的关键作用一致,ddhC在缺乏ZAK的细胞中未能抑制翻译(图6D)。
(7)Viperin通过核糖体碰撞依赖的翻译抑制来限制病毒复制
最后,作者阐释了viperin抗病毒活性的机制。293T.iVip细胞中viperin显著降低了西尼罗河病毒昆津株(WNVKUNV)的复制(图7A)。而且,表达viperin的细胞在24 hpi时降低了约80%(图7B),而病毒RNA水平仅中度减弱(图7C)。
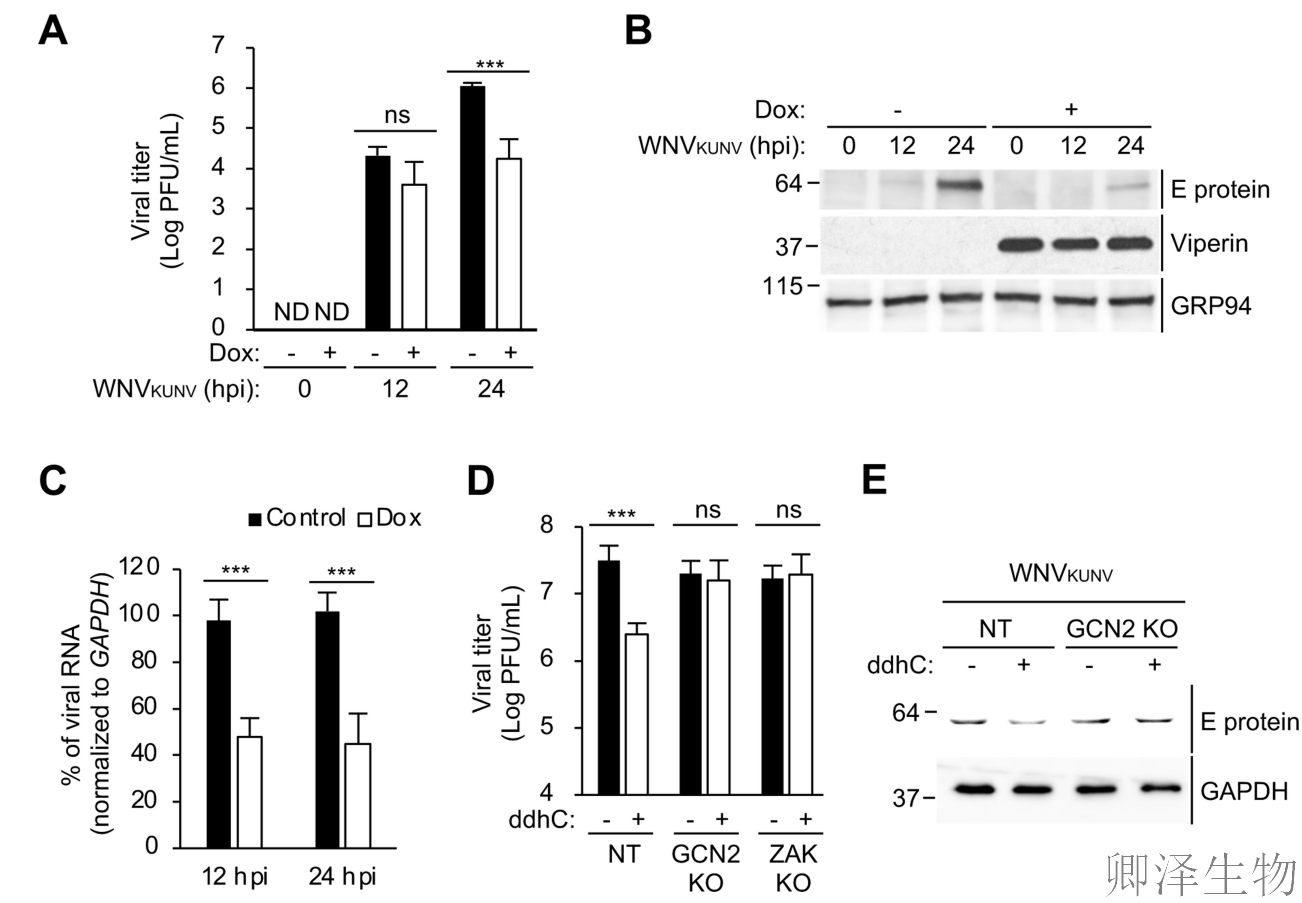
接下来,作者研究了GCN2和ZAK在ddhC治疗中抑制WNVKUNV复制是否必要。首先,ddhC在对照细胞中显著抑制WNVKUNV的复制,类似于对ZIKV复制的影响。然而,ddhC在缺乏GCN2或ZAK的细胞中未能抑制病毒复制(图7D)。其次,ddhC在对照细胞中降低了WNVKUNV病毒蛋白的表达,但在GCN2 KO细胞中没有降低WNVKUNV病毒蛋白的表达(图7E)。
总之,这些结果支持了一个模型,即viperin通过核糖体碰撞触发ISR来抑制病毒复制。
研究结论
Viperin是一种广谱抗病毒蛋白,通过限制病毒蛋白的产生来抑制两种医学上相关的病毒复制。Viperin合成的核苷衍生物ddhCTP可诱导核糖体碰撞,从而激活综合应激反应,从而抑制翻译。
欢迎致电了解详情或咨询!
广州卿泽生物科技有限公司
地址:广州市黄埔区伴河路96号一栋三层321房
电话:18925086102(微信同号)



