polysome profil
ing 富集检测 ¥6800
广州卿泽生物科技有限公司
入驻年限:5 年
- 联系人:
吴小姐
- 所在地区:
广东 广州市 黄埔区
- 业务范围:
医疗器械、体外诊断、论文服务、细胞库 / 细胞培养、试剂、技术服务
- 经营模式:
经销商 生产厂商
推荐产品
公司新闻/正文
Mol Cell. | m6A负向调控翻译的机制研究
人阅读 发布时间:2024-04-24 12:03
导读:
在细胞质中, mRNA被动态地划分为翻译池和非翻译池,但这种调节的机制在很大程度上仍然是未知的。

本研究提出:m6A可调节mRNA在多聚核糖体(Polysome)和P-body之间的分布。通过m6A-LAIC-seq和m6A-LC-MS/MS在HeLa细胞中量化Polysome和细胞质mRNA的m6A水平,作者观察到Polysome相关的 mRNA是低m6A甲基化的,而在P-body中富集的 mRNA是高m6A甲基化的。
当m6A Writer--METTL14下调时,可将原本高m6A修饰的mRNA从P-body切换到Polysome中,以增强翻译。通过蛋白质组学分析,作者发现了一个特定的m6A Reader--IGF2BP3富集于P-body。而且IGF2BP3是将靶mRNA从Polysome切换到P-body的必要和充分条件。这些发现为mRNA在翻译和非翻译池之间以依赖于m6A的方式分配的动态调节提供了一个模型。
文章索引
标题:m6A modification negatively regulates translation by switching mRNA from polysome to P-body via IGF2BP3.
发表期刊:Molecular Cell
发表时间:2023.11
作者及团队:武汉大学周宇教授团队
IF:16
DOI:10.1016/j.molcel.2023.10.040.
研究思路

研究结果
首先联合Polysome-seq和RNA-seq来分析HeLa细胞中单个mRNA的翻译速率(TR)。同时,对总RNA进行m6A-LAIC-seq (m6A亲和层析和测序),以测量每个mRNA上的m6A水平。从这些分析中,作者得以评估了10,837个细胞质mRNA和10,865个Polysome RNA的m6A水平。

作者比较了Polysome和细胞质中所有mRNA的m6A水平,发现与细胞质 mRNA相比,Polysome部分的mRNA总体上m6A水平显著较低(图1B)。RT-qPCR进一步证实了这种差异(图1C)。此外,作者使用m6A-LC-MS/MS分别定量了Polysome和细胞质RNA的m6A水平,发现Polysome mRNA的m6A/A比值比细胞质mRNA低(图1D)。这些结果表明,主动翻译mRNA的m6A水平较低,表明m6A水平高的mRNA不能有效翻译。
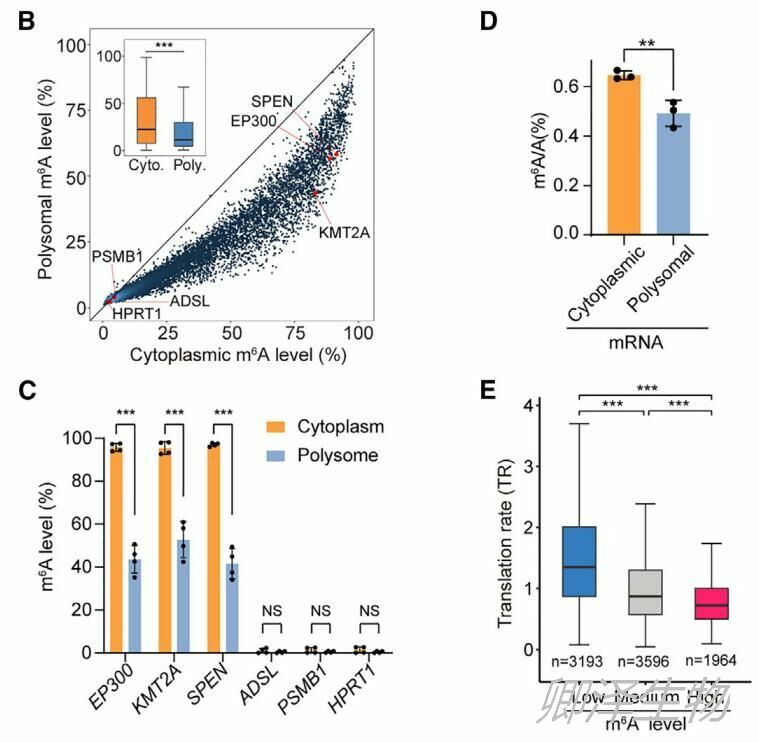

作者根据mRNA的m6A水平将其分为三组(低、中、高),发现m6A水平与细胞质mRNA的TR呈负相关(图1E)。以两个代表性基因为例,EP300 mRNA具有低TR但高m6A水平,而ADSL则具有高TR但低m6A水平(图1F和图1G)。上述结果表明m6A对mRNA翻译有负面影响。
(2)高度m6A甲基化的mRNA在P-body中富集
上述结果显示Polysome mRNA具有相对较低的m6A水平(图1D),因此作者推测:m6A修饰的RNA可能储存在细胞质中的某些亚细胞器中,从而与翻译机器隔离。已知P-body是储存未翻译mRNA的无膜细胞器,那含有m6A的 mRNA是否在P-body中积累呢?
作者对P-body进行了GFP-LSM14A标记,荧光激活颗粒分选(FAPS)纯化后,然后进行RNA-seq,计算所有mRNA的相对PE评分(图2A-B)。结果显示:PE分数与大多数mRNA的TRs呈负相关(图2C),P-body RNA富集分数与m6A水平呈正相关(图2D)。以两个代表性基因为例,EP300 mRNA具有高m6A水平和较大的PE,而ADSL mRNA具有低m6A水平和较小的PE(图2E-F)。

另外,与Ploysome样本相反,m6A LC-MS/MS结果显示,P-body RNA与细胞质mRNA相比具有更高的m6A/A比率(图2G)。

作者进一步使用smiFISH检测了m6A高水平mRNA和m6A低水平mRNA的亚细胞定位。结果发现m6A高水平mRNA确实都定位于P-body中(图2H)。此外,P-body富集基因的GO分析显示,其生物学途径与高m6A水平基因相似(图2I-J)。总的来说,这些结果表明P-body中翻译抑制的mRNA高度甲基化。
(3)HeLa细胞中,m6A的缺失导致 mRNA从P-body重新分布到Polysome
鉴于高m6A水平的mRNA低翻译,且在P-body中富集,作者下一步试图研究干扰m6A水平是否会影响Polysome和P-body中的mRNA分布。
作者以EIF3A基因缺失为阳性对照,采用Polysome profiling技术发现METTL14敲低后Polysome组分显著增加(图3A)。同时,对METTL14敲除和对照样本的进行了Polysome-seq和总RNA-seq。分析显示:METTL14的敲低增强了那些最初被m6A修饰的mRNA的翻译,并且m6A水平越高,这种作用越为显著(图3B-C)。

此外,RT-qPCR验证了METTL14敲低增强了高m6A基因的翻译(图3D)。Western blot发现翻译上调基因确实显示出更高的蛋白水平(图3E)。总之,这些数据表明,减少m6A修饰会导致更多的mRNA进入具有更高TR的Polysome中。
m6A是否调节P-body中mRNA的积累?为了系统地研究这种变化,作者纯化了P-body,并对METTL14敲除和对照样本的RNA进行了测序。结合m6A-LAIC-seq数据,发现METTL14缺失后,PE降低的mRNA(364个高m6A的 mRNA和336个中等m6A的 mRNA)比PE增加的mRNA(76个高m6A的 mRNA和213个中等m6A的 mRNA)的数量更多(图3F)。
m6A修饰的mRNA倾向于在METTL14敲低后从P-body中逃逸,因为PE的降低与其原始m6A水平呈负相关(图3G)。RT-qPCR进一步证实了m6A高水平 mRNA在P-body中的富集减少,而m6A低水平 mRNA则没有(图3H)。

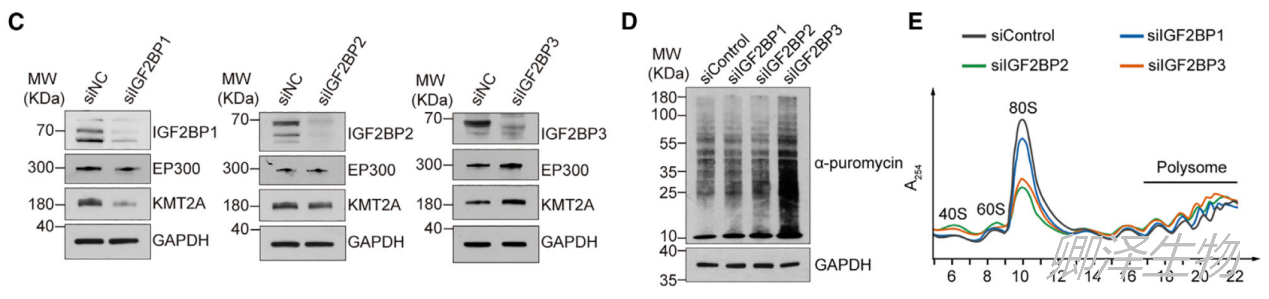
接下来,作者研究了IGF2BPs在调节 mRNA翻译中的潜在作用。Western blotting结果显示:IGF2BP3的敲低使EP300和KMT2A的蛋白水平升高,而IGF2BP1或IGF2BP2的敲低使蛋白水平变化不大,甚至略有下降(图4C)。嘌呤霉素掺入实验发现只有IGF2BP3的敲低会导致蛋白质合成剧烈增加(图4D)。Polysome profiling分析发现IGF2BP2和IGF2BP3的敲低都导致Polysome组分增加,并且IGF2BP3敲低的影响更大(图4E)。
考虑到IGF2BP3在P-body中富集,而P-body也含有许多翻译抑制因子,如图4A所示的4E-T。因此作者研究了IGF2BP3是否直接与这些翻译抑制因子相互作用。Co-IP验证了IGF2BP3以不依赖RNA的方式与4E-T和DDX6相关,而IGF2BP1和IGF2BP2与4E-T的相互作用较弱,不与DDX6结合(图4F-4H),表明IGF2BP3介导的相互作用有助于将 mRNA定位到P-body中。

结果显示:IGF2BP3缺失后,579个m6A高水平mRNA和733个m6A中等水平mRNA与Polysome相关性增加,208个m6A高水平mRNA和714个m6A中等水平mRNA的TR降低(图5A)。
整体来看,IGF2BP3敲低后,m6A水平较高的mRNA的TR增加更多(图5A-B)。RT-qPCR证实,IGF2BP3的敲低增加了m6A高水平mRNA的翻译,但对m6A低水平mRNA的翻译影响不大(图5C)。

此外,作者分别对IGF2BP3、METTL14或YTHDF1敲降细胞的Polysome-RNA和胞质mRNA进行了m6A LC-MS/MS。IGF2BP3敲低后Polysome mRNA的m6A/A比值增加,而METTL14或YTHDF1敲低时则没有增加(图5D)。值得注意的是,IGF2BP3敲低后,胞质总mRNA中的m6A/A比值没有明显变化(图5D)。METTL14和IGF2BP3敲低样本之间翻译增加的 mRNA有相当多的重叠(图5E)。
整体来看,当IGF2BP3敲低时,m6A修饰的mRNA倾向于从P-body中逃逸,因为PE的降低与其原始m6A水平呈负相关(图5F-G)。代表性基因的RT-qPCR证实了这一模式(图5H)。
此外,对IGF2BP3敲低和对照细胞的P-body和细胞质mRNA进行了m6A LC-MS/MS,观察到IGF2BP3敲低后P-body mRNA的m6A/A比值降低(图5I)。
因此,无论是通过敲低METTL14来降低mRNA上的m6A水平,还是通过降低IGF2BP3来阻断mRNA向P-body的运输,都会导致那些原本具有高水平m6A修饰的mRNA的PE降低和TR增加,而低m6A水平的mRNA则缺乏这种变化(图5J)。综上所述,这些结果表明IGF2BP3调节了m6A修饰转录本在Polysome和P-body之间的分布。

将FLAG-IGF2BP3-MCP系在报告基因mRNA上导致荧光素酶表达减少约30%(图6C),而其mRNA丰度没有显著变化(图6D),翻译效率与对照组相比下降了约40%(图6E)。RT-qPCR进一步检测了转染MCP或IGF2BP3-MCP的细胞中Rluc-MS2 mRNA在核糖体组分的分布。在表达IGF2BP3-MCP的细胞中,Rluc-MS2 mRNA的相对分布从Heavy polysome组分向Light polysome和Monosome组分转变(图6F),表明由于IGF2BP3结合而导致翻译减少。
为了检测报告基因 mRNA的定位,作者将20个BoxB茎环克隆到Rluc-MS2的3'UTR中,并将其与融合了mCherry的BoxB外壳蛋白λN (λN-mCherry)共转染(图6G)。结果发现,将IGF2BP3-MCP粘附到报告mRNA上可驱动 mRNA进入P-body,而MCP单独缺乏这种效果(图6H)。
综上所述,这些结果表明IGF2BP3的结合可直接将靶点重新分配到P-body上,从而抑制了mRNA的翻译。
研究结论
这项工作揭示了:
欢迎致电了解详情或咨询!
广州卿泽生物科技有限公司
地址:广州市黄埔区伴河路96号一栋三层321房
电话:18925086102(微信同号)
在细胞质中, mRNA被动态地划分为翻译池和非翻译池,但这种调节的机制在很大程度上仍然是未知的。

- body(Processing bodies)是由核糖核蛋白(RNP)颗粒动态组装而成的细胞质无膜RNA颗粒。研究表明,P-body可促进mRNA的衰变,主要参与mRNA的储存和翻译抑制,即P-body中存在大量非翻译mRNA。
本研究提出:m6A可调节mRNA在多聚核糖体(Polysome)和P-body之间的分布。通过m6A-LAIC-seq和m6A-LC-MS/MS在HeLa细胞中量化Polysome和细胞质mRNA的m6A水平,作者观察到Polysome相关的 mRNA是低m6A甲基化的,而在P-body中富集的 mRNA是高m6A甲基化的。
当m6A Writer--METTL14下调时,可将原本高m6A修饰的mRNA从P-body切换到Polysome中,以增强翻译。通过蛋白质组学分析,作者发现了一个特定的m6A Reader--IGF2BP3富集于P-body。而且IGF2BP3是将靶mRNA从Polysome切换到P-body的必要和充分条件。这些发现为mRNA在翻译和非翻译池之间以依赖于m6A的方式分配的动态调节提供了一个模型。
文章索引
标题:m6A modification negatively regulates translation by switching mRNA from polysome to P-body via IGF2BP3.
发表期刊:Molecular Cell
发表时间:2023.11
作者及团队:武汉大学周宇教授团队
IF:16
DOI:10.1016/j.molcel.2023.10.040.
研究思路

研究结果
- Polysome中翻译状态的mRNA呈现低m6A甲基化
首先联合Polysome-seq和RNA-seq来分析HeLa细胞中单个mRNA的翻译速率(TR)。同时,对总RNA进行m6A-LAIC-seq (m6A亲和层析和测序),以测量每个mRNA上的m6A水平。从这些分析中,作者得以评估了10,837个细胞质mRNA和10,865个Polysome RNA的m6A水平。

作者比较了Polysome和细胞质中所有mRNA的m6A水平,发现与细胞质 mRNA相比,Polysome部分的mRNA总体上m6A水平显著较低(图1B)。RT-qPCR进一步证实了这种差异(图1C)。此外,作者使用m6A-LC-MS/MS分别定量了Polysome和细胞质RNA的m6A水平,发现Polysome mRNA的m6A/A比值比细胞质mRNA低(图1D)。这些结果表明,主动翻译mRNA的m6A水平较低,表明m6A水平高的mRNA不能有效翻译。


作者根据mRNA的m6A水平将其分为三组(低、中、高),发现m6A水平与细胞质mRNA的TR呈负相关(图1E)。以两个代表性基因为例,EP300 mRNA具有低TR但高m6A水平,而ADSL则具有高TR但低m6A水平(图1F和图1G)。上述结果表明m6A对mRNA翻译有负面影响。
(2)高度m6A甲基化的mRNA在P-body中富集
上述结果显示Polysome mRNA具有相对较低的m6A水平(图1D),因此作者推测:m6A修饰的RNA可能储存在细胞质中的某些亚细胞器中,从而与翻译机器隔离。已知P-body是储存未翻译mRNA的无膜细胞器,那含有m6A的 mRNA是否在P-body中积累呢?
作者对P-body进行了GFP-LSM14A标记,荧光激活颗粒分选(FAPS)纯化后,然后进行RNA-seq,计算所有mRNA的相对PE评分(图2A-B)。结果显示:PE分数与大多数mRNA的TRs呈负相关(图2C),P-body RNA富集分数与m6A水平呈正相关(图2D)。以两个代表性基因为例,EP300 mRNA具有高m6A水平和较大的PE,而ADSL mRNA具有低m6A水平和较小的PE(图2E-F)。

另外,与Ploysome样本相反,m6A LC-MS/MS结果显示,P-body RNA与细胞质mRNA相比具有更高的m6A/A比率(图2G)。

作者进一步使用smiFISH检测了m6A高水平mRNA和m6A低水平mRNA的亚细胞定位。结果发现m6A高水平mRNA确实都定位于P-body中(图2H)。此外,P-body富集基因的GO分析显示,其生物学途径与高m6A水平基因相似(图2I-J)。总的来说,这些结果表明P-body中翻译抑制的mRNA高度甲基化。
(3)HeLa细胞中,m6A的缺失导致 mRNA从P-body重新分布到Polysome
鉴于高m6A水平的mRNA低翻译,且在P-body中富集,作者下一步试图研究干扰m6A水平是否会影响Polysome和P-body中的mRNA分布。
作者以EIF3A基因缺失为阳性对照,采用Polysome profiling技术发现METTL14敲低后Polysome组分显著增加(图3A)。同时,对METTL14敲除和对照样本的进行了Polysome-seq和总RNA-seq。分析显示:METTL14的敲低增强了那些最初被m6A修饰的mRNA的翻译,并且m6A水平越高,这种作用越为显著(图3B-C)。

此外,RT-qPCR验证了METTL14敲低增强了高m6A基因的翻译(图3D)。Western blot发现翻译上调基因确实显示出更高的蛋白水平(图3E)。总之,这些数据表明,减少m6A修饰会导致更多的mRNA进入具有更高TR的Polysome中。
m6A是否调节P-body中mRNA的积累?为了系统地研究这种变化,作者纯化了P-body,并对METTL14敲除和对照样本的RNA进行了测序。结合m6A-LAIC-seq数据,发现METTL14缺失后,PE降低的mRNA(364个高m6A的 mRNA和336个中等m6A的 mRNA)比PE增加的mRNA(76个高m6A的 mRNA和213个中等m6A的 mRNA)的数量更多(图3F)。
m6A修饰的mRNA倾向于在METTL14敲低后从P-body中逃逸,因为PE的降低与其原始m6A水平呈负相关(图3G)。RT-qPCR进一步证实了m6A高水平 mRNA在P-body中的富集减少,而m6A低水平 mRNA则没有(图3H)。
- P-body因子IGF2BP3的缺失增强了HeLa细胞的mRNA翻译

接下来,作者研究了IGF2BPs在调节 mRNA翻译中的潜在作用。Western blotting结果显示:IGF2BP3的敲低使EP300和KMT2A的蛋白水平升高,而IGF2BP1或IGF2BP2的敲低使蛋白水平变化不大,甚至略有下降(图4C)。嘌呤霉素掺入实验发现只有IGF2BP3的敲低会导致蛋白质合成剧烈增加(图4D)。Polysome profiling分析发现IGF2BP2和IGF2BP3的敲低都导致Polysome组分增加,并且IGF2BP3敲低的影响更大(图4E)。

考虑到IGF2BP3在P-body中富集,而P-body也含有许多翻译抑制因子,如图4A所示的4E-T。因此作者研究了IGF2BP3是否直接与这些翻译抑制因子相互作用。Co-IP验证了IGF2BP3以不依赖RNA的方式与4E-T和DDX6相关,而IGF2BP1和IGF2BP2与4E-T的相互作用较弱,不与DDX6结合(图4F-4H),表明IGF2BP3介导的相互作用有助于将 mRNA定位到P-body中。

- IGF2BP3在Polysome和P-body之间重新分配m6A修饰的mRNA
结果显示:IGF2BP3缺失后,579个m6A高水平mRNA和733个m6A中等水平mRNA与Polysome相关性增加,208个m6A高水平mRNA和714个m6A中等水平mRNA的TR降低(图5A)。
整体来看,IGF2BP3敲低后,m6A水平较高的mRNA的TR增加更多(图5A-B)。RT-qPCR证实,IGF2BP3的敲低增加了m6A高水平mRNA的翻译,但对m6A低水平mRNA的翻译影响不大(图5C)。

此外,作者分别对IGF2BP3、METTL14或YTHDF1敲降细胞的Polysome-RNA和胞质mRNA进行了m6A LC-MS/MS。IGF2BP3敲低后Polysome mRNA的m6A/A比值增加,而METTL14或YTHDF1敲低时则没有增加(图5D)。值得注意的是,IGF2BP3敲低后,胞质总mRNA中的m6A/A比值没有明显变化(图5D)。METTL14和IGF2BP3敲低样本之间翻译增加的 mRNA有相当多的重叠(图5E)。
整体来看,当IGF2BP3敲低时,m6A修饰的mRNA倾向于从P-body中逃逸,因为PE的降低与其原始m6A水平呈负相关(图5F-G)。代表性基因的RT-qPCR证实了这一模式(图5H)。
此外,对IGF2BP3敲低和对照细胞的P-body和细胞质mRNA进行了m6A LC-MS/MS,观察到IGF2BP3敲低后P-body mRNA的m6A/A比值降低(图5I)。
因此,无论是通过敲低METTL14来降低mRNA上的m6A水平,还是通过降低IGF2BP3来阻断mRNA向P-body的运输,都会导致那些原本具有高水平m6A修饰的mRNA的PE降低和TR增加,而低m6A水平的mRNA则缺乏这种变化(图5J)。综上所述,这些结果表明IGF2BP3调节了m6A修饰转录本在Polysome和P-body之间的分布。
- IGF2BP3直接抑制mRNA翻译并将mRNA重新定位到P-body

将FLAG-IGF2BP3-MCP系在报告基因mRNA上导致荧光素酶表达减少约30%(图6C),而其mRNA丰度没有显著变化(图6D),翻译效率与对照组相比下降了约40%(图6E)。RT-qPCR进一步检测了转染MCP或IGF2BP3-MCP的细胞中Rluc-MS2 mRNA在核糖体组分的分布。在表达IGF2BP3-MCP的细胞中,Rluc-MS2 mRNA的相对分布从Heavy polysome组分向Light polysome和Monosome组分转变(图6F),表明由于IGF2BP3结合而导致翻译减少。
为了检测报告基因 mRNA的定位,作者将20个BoxB茎环克隆到Rluc-MS2的3'UTR中,并将其与融合了mCherry的BoxB外壳蛋白λN (λN-mCherry)共转染(图6G)。结果发现,将IGF2BP3-MCP粘附到报告mRNA上可驱动 mRNA进入P-body,而MCP单独缺乏这种效果(图6H)。
综上所述,这些结果表明IGF2BP3的结合可直接将靶点重新分配到P-body上,从而抑制了mRNA的翻译。
研究结论
这项工作揭示了:
- Polysome相关mRNA是低m6A甲基化的;
- P-body相关mRNA是超m6a甲基化的;
- 全局m6A降低,将mRNA从P-body转至到Polysome;
- 在HeLa细胞中,m6A reader--IGF2BP3驱动m6A甲基化的mRNA到P-body中。

欢迎致电了解详情或咨询!
广州卿泽生物科技有限公司
地址:广州市黄埔区伴河路96号一栋三层321房
电话:18925086102(微信同号)









