广州卿泽生物科技有限公司
6 年
手机商铺
- NaN
- 0.8999999999999999
- 1.9
- 0.8999999999999999
- 3.9
推荐产品
公司新闻/正文
【circRNA翻译】 | 环状RNA编码新型蛋白,成前列腺癌治疗新靶点!
84 人阅读发布时间:2025-10-30 15:59
导读:
前列腺癌是全球男性中发病率第二的癌症,每年新发病例预计将从2020年的140万增至2040年的290万。尽管现有疗法如雄激素剥夺疗法(ADT)和新一代抗雄药物(如阿比特龙、恩杂坦米)已取得一定进展,但对晚期患者尤其是转移性前列腺癌的治疗效果仍十分有限。肿瘤异质性也限制了PARP抑制剂和免疫疗法等新策略的应用。

近年来,环状RNA(circRNA)作为一类共价闭合的非编码RNA,在肿瘤发生发展中的作用日益受到关注。新研究发现,circSPIRE1可通过“滚动圈翻译”机制编码一种新型蛋白rtSPIRE1,并通过稳定LRP5蛋白激活PI3K/AKT信号通路,从而促进前列腺癌的增殖和转移。该研究不仅揭示了circRNA编码功能在癌症中的重要作用,还为前列腺癌的诊断和治疗提供了新的潜在靶点。
文章索引:
标题:A novel polypeptide encoded by circSPIRE1 promotes prostate cancer proliferation and migration by restraining the ubiquitin-dependent degradation of LRP5.
发表期刊:《Journal of Experimental & Clinical Cancer Research》.
发表时间:2025.07
作者团队:中山大学孙逸仙纪念医院泌尿外科 许可慰教授团队
IF:12.8
DOI:10.1186/s13046-025-03467-8.
翻译组学技术在该研究中的运用
本研究充分利用了翻译组学技术,尤其是多核糖体分析(polysome profiling),来解析circSPIRE1的翻译活性。通过蔗糖梯度离心分离不同翻译状态的核糖体复合物,并结合RT-qPCR和Western blot,研究团队证实了circSPIRE1与多核糖体的结合,表明其具有活跃的翻译功能。
研究结果
(1)circSPIRE1在前列腺癌中的识别和表征
为了探索环状RNA(circRNAs)在前列腺癌进展中的潜在作用,作者对三名前列腺癌患者的癌组织和癌旁正常组织进行了高通量circRNA微阵列分析(图1A)。发现前列腺癌组织中45个circRNA显著上调、192个下调(图1B),并从中筛选出七个具有翻译潜能的circRNA,其中circSPIRE1表达最显著(图1C)。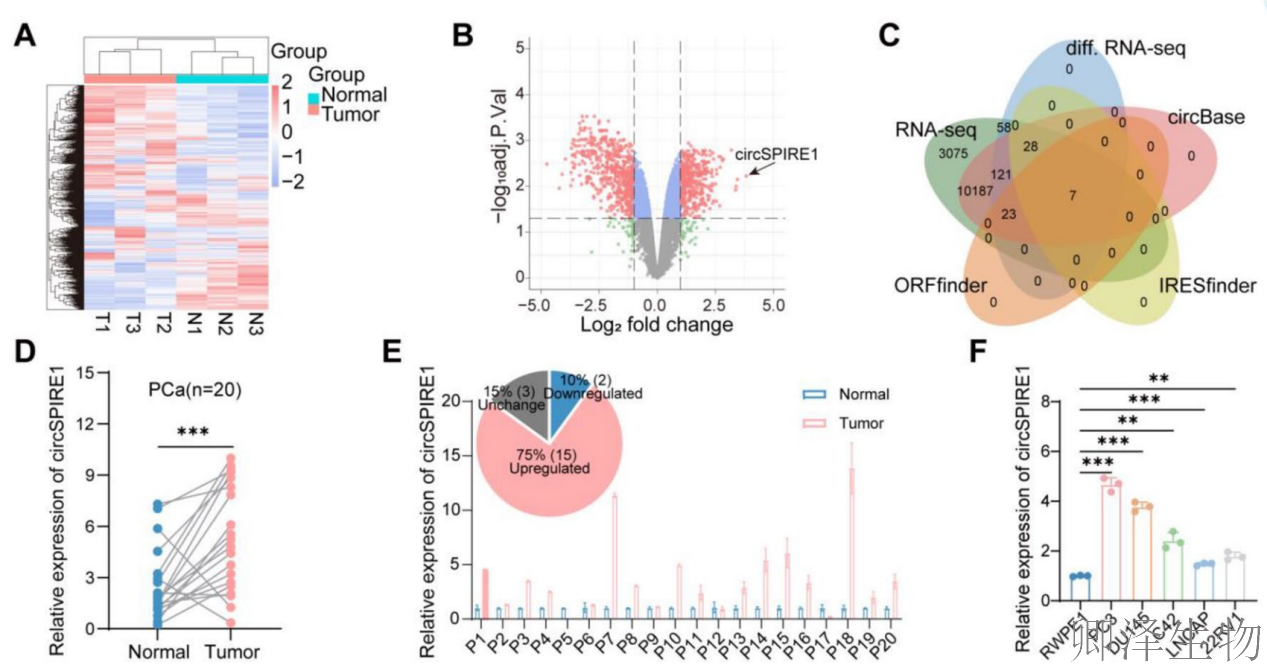
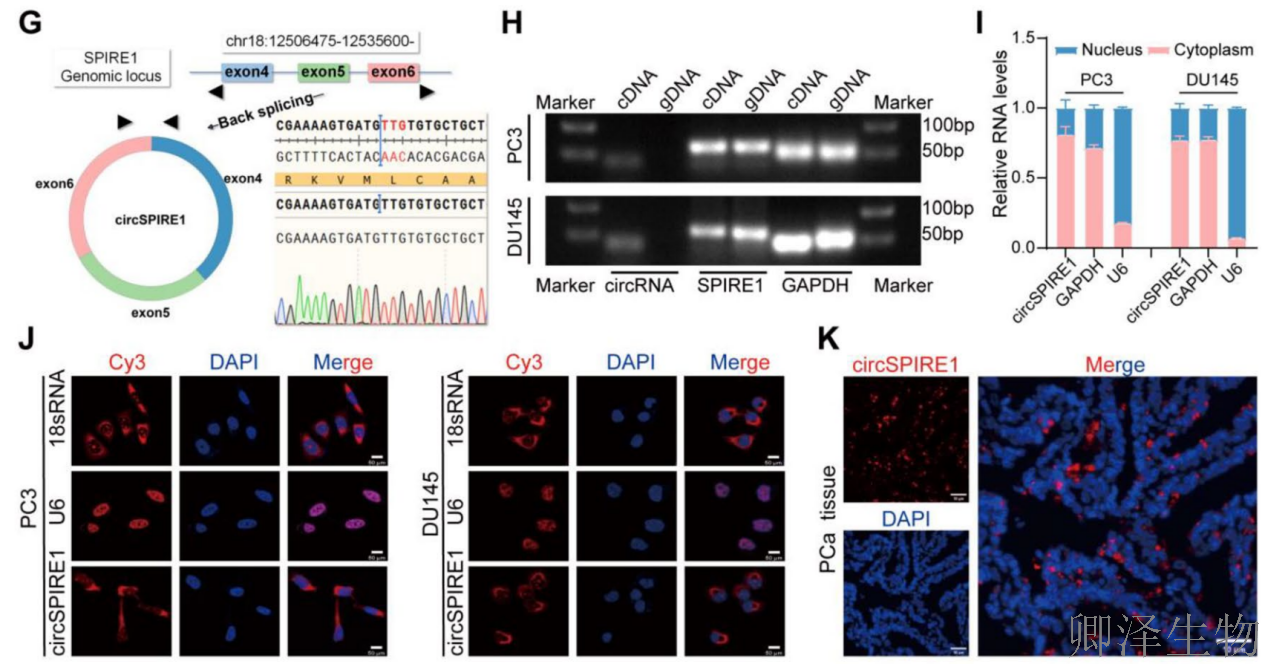
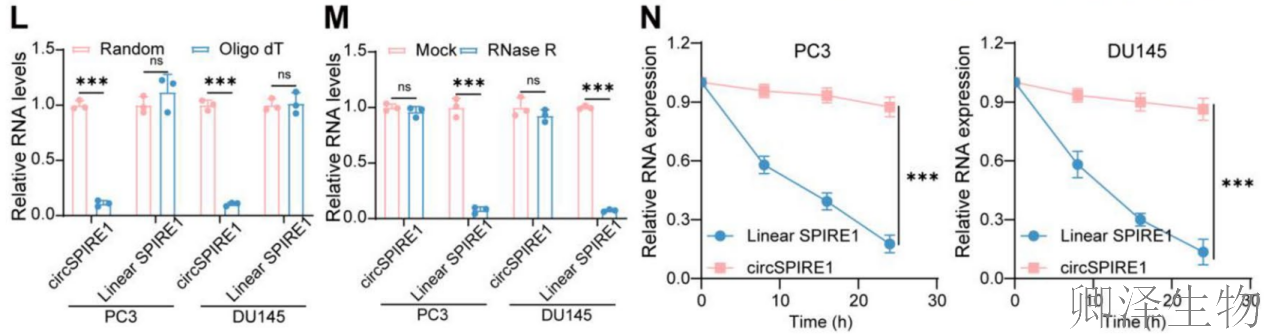
RT-qPCR验证显示circSPIRE1在癌组织和细胞系(尤其PC3和DU145)中高表达(图1D-F)。分子特征分析证实circSPIRE1通过反向剪接形成(图1G),仅存在于cDNA中(图1H),主要定位于细胞质(图1I-K),且为非多聚腺苷酸化结构(图1L)。稳定性实验表明circSPIRE1比线性RNA更稳定(图1M-N),提示其作为稳定环状RNA在细胞质中可能发挥功能。
(2)circSPIRE1与临床特征相关并促进前列腺癌进展
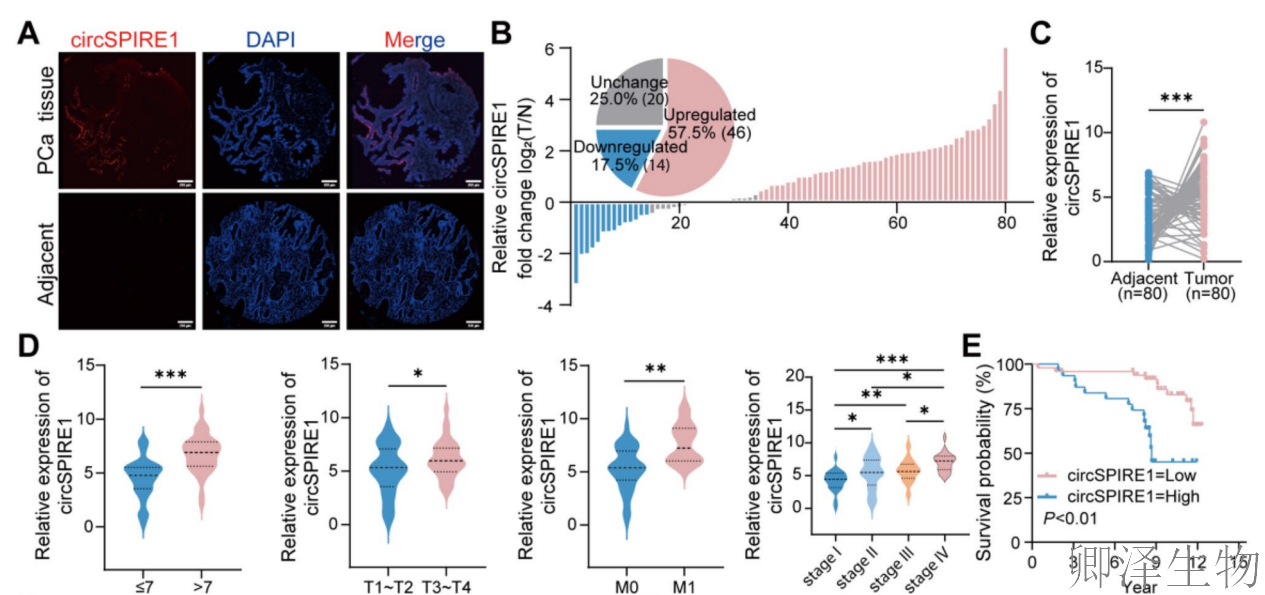
随后,作者进一步探讨circSPIRE1在前列腺癌中的表达模式及临床意义。通过FISH成像分析(图2A),发现circSPIRE1在前列腺癌组织中表达显著上调(红色信号),与癌旁正常组织相比差异明显,细胞核由DAPI染色(蓝色)。对80例患者的定量分析显示,57.50%的病例中circSPIRE1表达上调,17.50%下调,25.00%无变化(图2B)。进一步相关性分析表明,circSPIRE1高表达与更高Gleason评分(>7)、晚期肿瘤分期(T3-T4)、转移状态(M1)和临床分期(III-IV)显著正相关(图2C-E),提示其作为前列腺癌进展的潜在生物标志物。
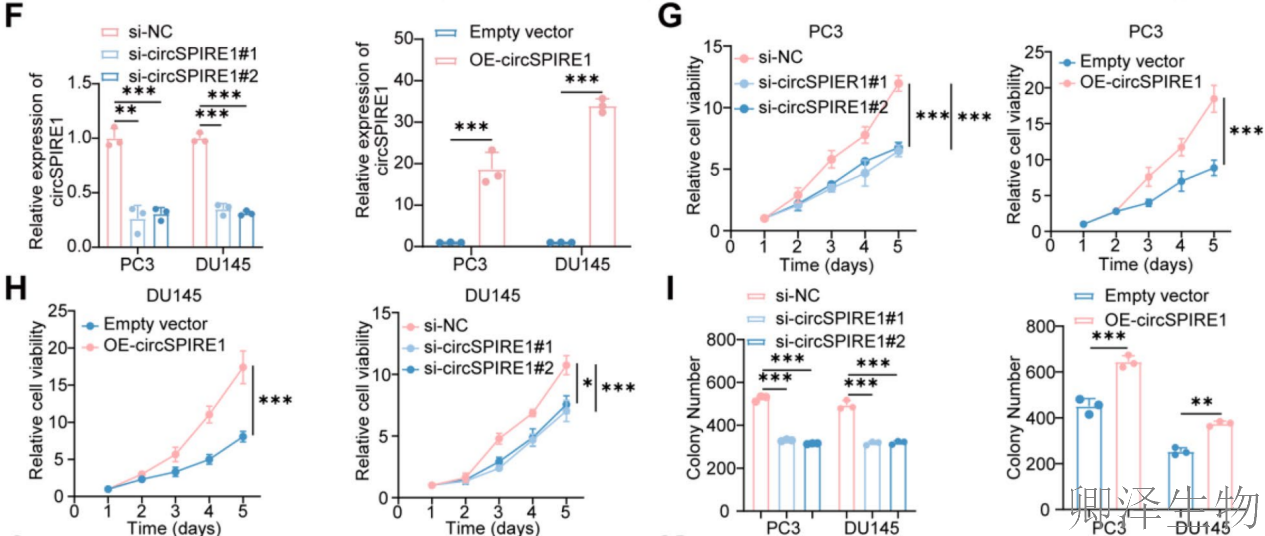
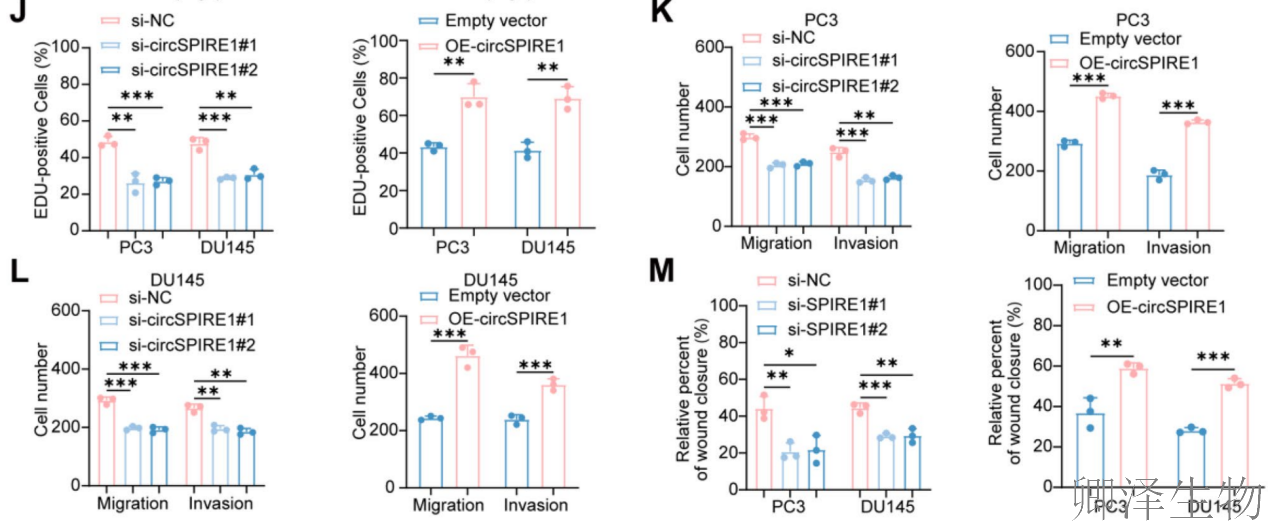
功能上,通过RT-qPCR验证了circSPIRE1敲低和过表达模型的有效性(图F),CCK8实验显示circSPIRE1过表达显著增强PC3和DU145细胞的活力和增殖(图2G-H),而克隆形成实验和EdU检测进一步证实其促进细胞增殖能力(图2I-J)。Transwell和伤口愈合实验表明,circSPIRE1过表达加剧细胞迁移和侵袭(图2K-M)。这些结果综合表明,circSPIRE1通过调控细胞增殖、迁移和侵袭,促进前列腺癌进展,且其表达水平与临床恶性特征紧密相关。
(3)circSPIRE1通过IRES介导的滚动环翻译驱动生物功能
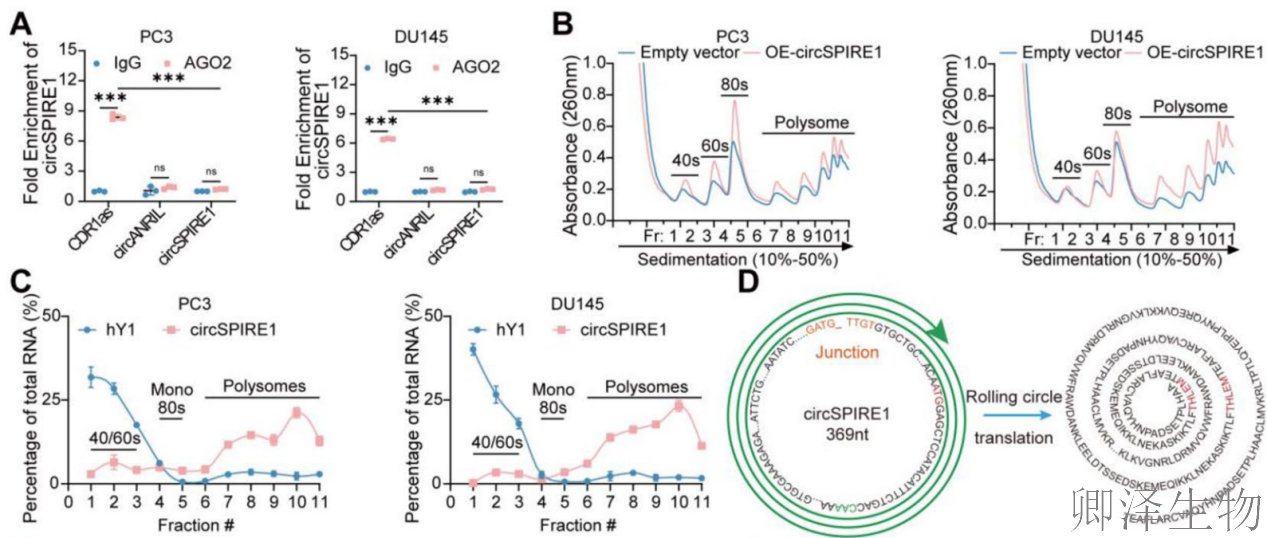
为了研究 circSPIRE1是否主要通过蛋白质翻译发挥作用而不是充当miRNA 海绵,作者进行了 RNA 免疫沉淀 (RIP) 试验(图3A)。发现circSPIRE1与AGO2结合较弱,表明其不太可能通过miRNA海绵机制发挥作用。Polysome profiling分析(图3B)显示,过表达circSPIRE1后,整体翻译活性提升。结合qPCR实验(图3C)进一步证实circSPIRE1主要与多核糖体结合(以hY1为阴性对照)。TransCirc数据库分析(图3D)识别出circSPIRE1包含一个由ATG起始但无终止密码子的开放阅读框(ORF),支持滚动圈翻译潜力。
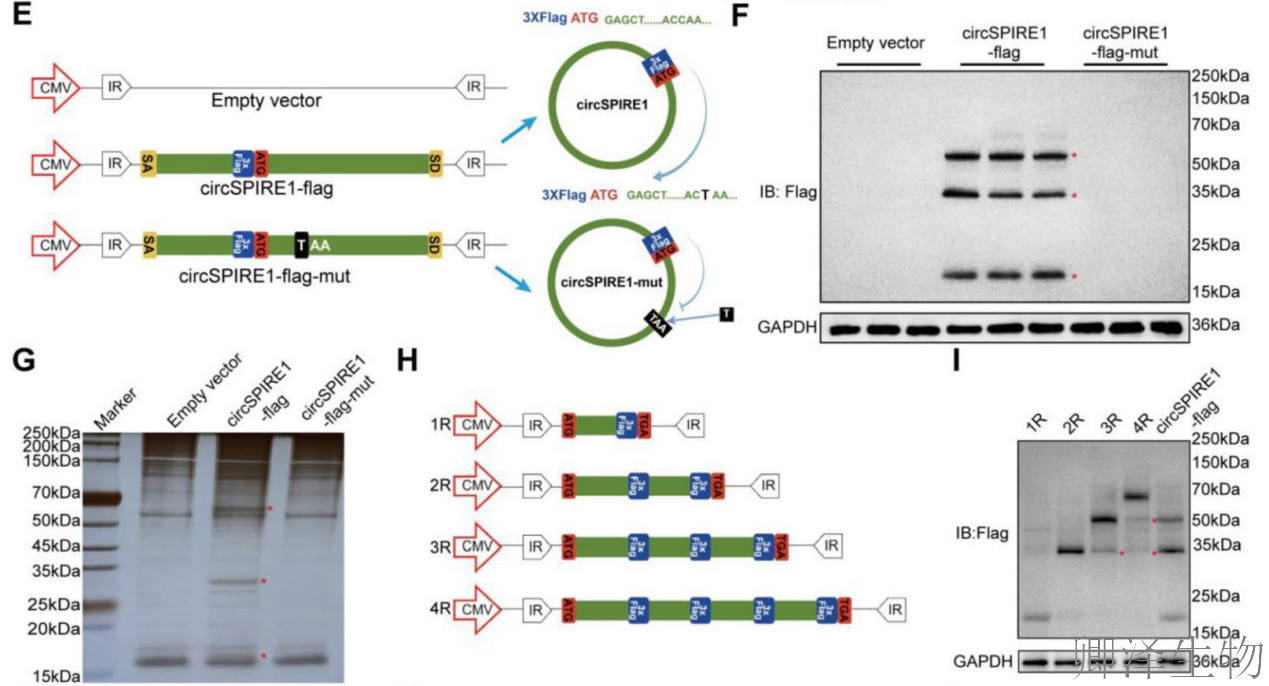
为验证翻译功能,设计了Flag标签构建体(图3E):circSPIRE1-Flag(完整ORF)和circSPIRE1-Flag-mut(引入终止密码子突变)。Western blot(图3F)在circSPIRE1-Flag组中检测到三个主要蛋白条带(约17 kDa),与ORF循环翻译产物一致;SDS-PAGE和质谱分析(图3G)确认这些条带为circSPIRE1编码的多肽,命名为rtSPIRE1。线性重复ORF构建体(1R-4R)的Western blot(图3H-I)显示,主要翻译产物对应1-3个ORF重复,支持滚动圈翻译终止于程序性核糖体移码。
双荧光素酶报告系统(图3J-K)证明全长circSPIRE1 IRES具有强活性(Luc/Rluc比值最高),显著高于缺失突变体,证实IRES驱动翻译。RNA pulldown(图3L)和Western blot验证(图3M-N)发现hnRNPA1特异性结合circSPIRE1;RIP实验(图3O-P)进一步显示hnRNPA1与野生型circSPIRE1结合增强,而与IRES缺失突变体结合减少,表明hnRNPA1通过IRES区域调控翻译。
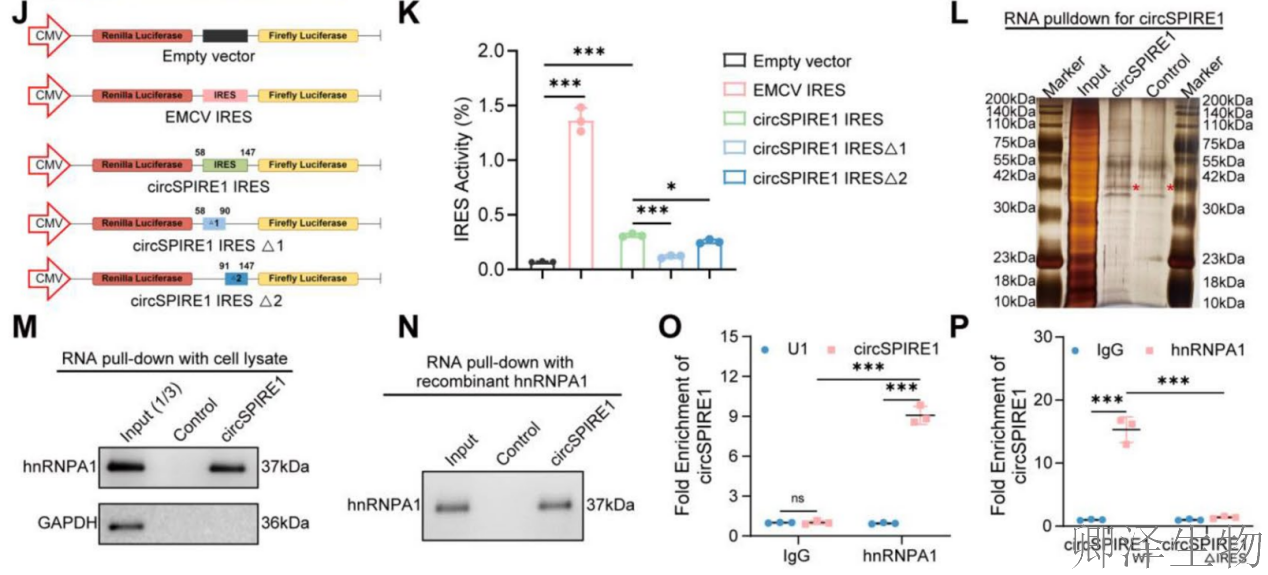
这些结果综合揭示circSPIRE1通过IRES介导的滚动圈翻译生成rtSPIRE1蛋白,且该过程受hnRNPA1调控,为其生物学功能提供机制基础。
(4)hnRNPA1 SDMA修饰促进circSPIRE1 IRES活性
---hnRNPA1与circSPIRE1的相互作用与功能验证
FISH结合免疫荧光技术(图4A)发现hnRNPA1与circSPIRE1在细胞质中显著共定位,提示两者可能存在直接相互作用。Western blot分析(图4B)显示,hnRNPA1敲低呈剂量依赖性降低circSPIRE1的翻译产物水平,表明hnRNPA1是circSPIRE1翻译的正调控因子。双荧光素酶报告实验(图4C)进一步证实,hnRNPA1敲低导致Fluc活性(代表IRES驱动翻译)剂量依赖性下降,而Rluc活性(内部控制)无变化,说明hnRNPA1特异性促进circSPIRE1 IRES活性。短期hnRNPA1敲低(150 nM)不影响细胞活力或circSPIRE1 RNA水平(图4D),排除非特异性效应。
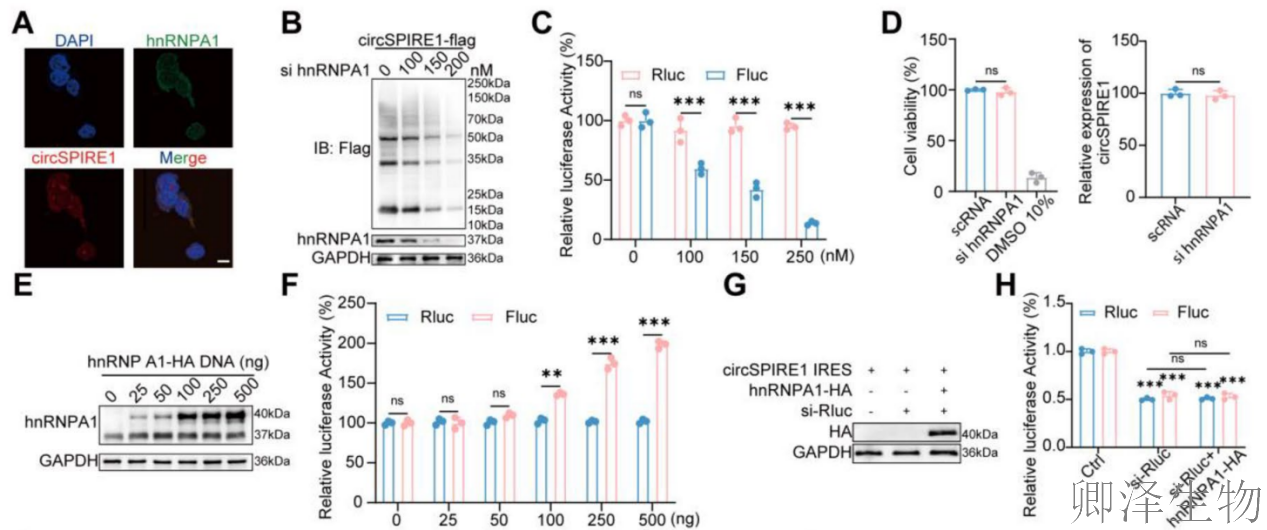
---hnRNPA1过表达与结合位点鉴定
过表达实验显示,外源hnRNPA1-HA表达剂量依赖性增加(图4E),并伴随Fluc活性升高(图4F),而Rluc活性不变,再次验证hnRNPA1对IRES的特异性增强作用。Rluc敲低实验(50 nM)验证了双荧光素酶报告系统(100 ng)的可靠性(图4G-H),确保IRES活性测量的准确性。分子对接分析(图I-J)识别出circSPIRE1 IRES区域的G-135位点为hnRNPA1的关键结合位点。RIP实验(图4K)显示,hnRNPA1与野生型circSPIRE1结合强烈,但与G135U突变体结合显著减少,证实该位点对相互作用至关重要。
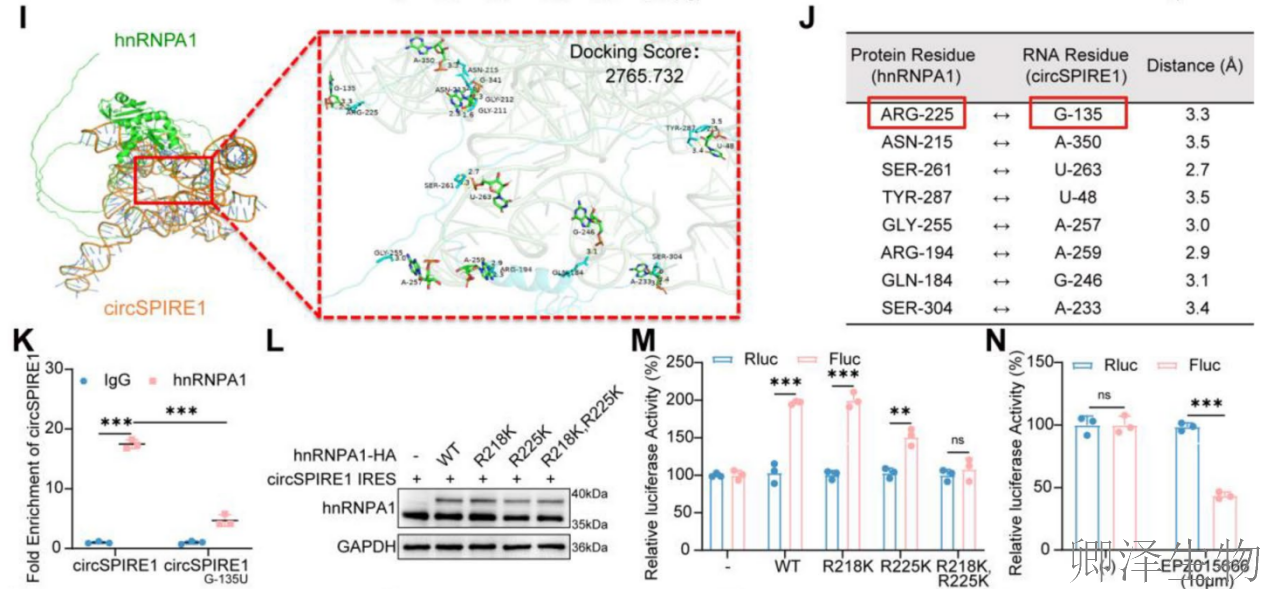
---SDMA修饰的核心调控作用
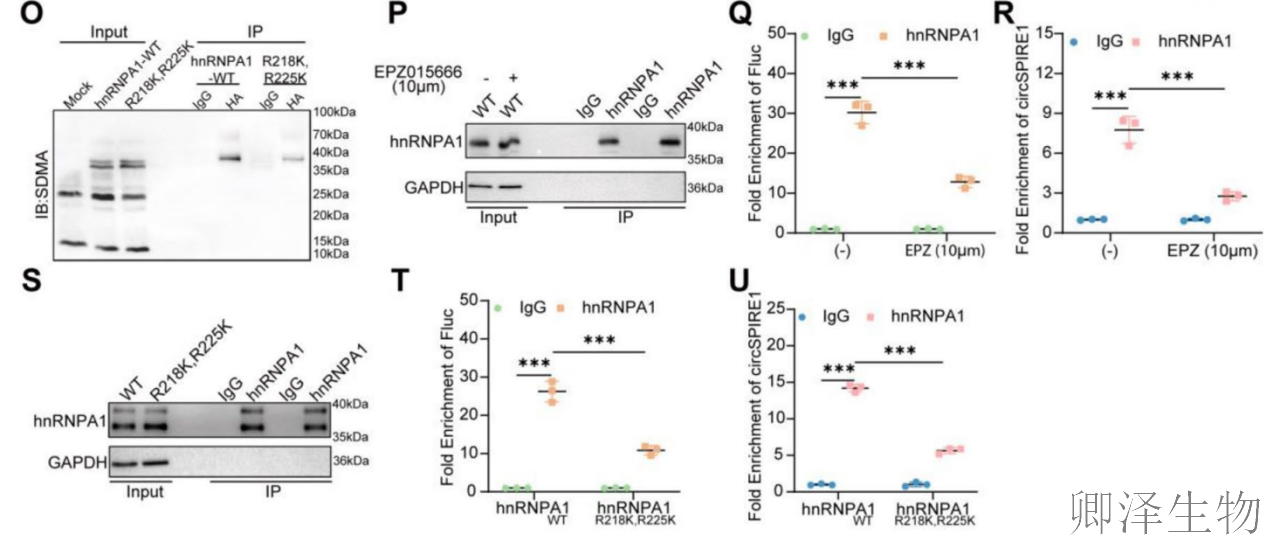
共转染实验(图4L-M)表明,hnRNPA1与circSPIRE1 IRES的相互作用呈剂量依赖性,影响Fluc活性。使用SDMA抑制剂EPZ015666(10 μM)处理(图4N),可显著降低Fluc活性而不影响Rluc,表明SDMA修饰是IRES活性必需的。IP实验(图4O)发现,hnRNPA1的R218K/R225K双突变体SDMA修饰水平大幅降低,提示这些精氨酸残基是SDMA修饰的关键位点。后续RIP实验(图4P-R)显示,EPZ015666处理或SDMA缺陷突变体(R218K/R225K)均导致hnRNPA1与Fluc及circSPIRE1的结合显著减少(图4S-U),证明SDMA修饰直接调控hnRNPA1与IRES的结合亲和力。
综上,hnRNPA1通过其SDMA修饰(尤其R218和R225位点)增强与circSPIRE1 IRES区域(G-135位点)的结合,从而促进IRES介导的翻译起始。这一修饰依赖性机制揭示了hnRNPA1作为转录后调控因子在circRNA翻译中的关键作用,为靶向SDMA通路干预前列腺癌进展提供了理论依据。
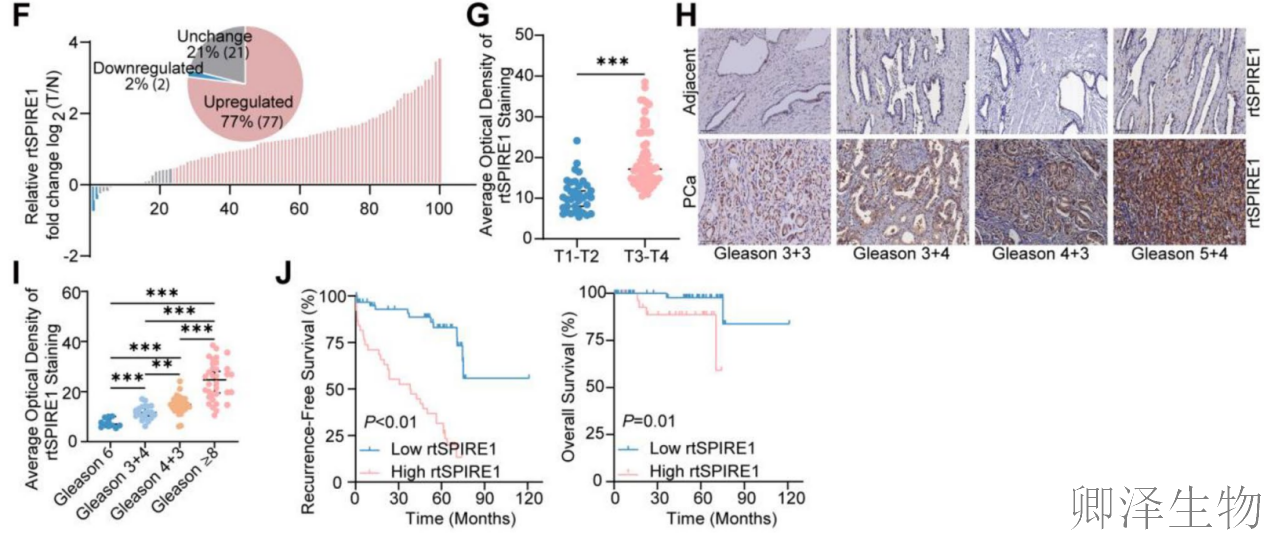
(5)新型蛋白rtSPIRE1在前列腺癌中的临床意义
为了验证针对独特rtSPIRE1肽序列(RKVMLCAAHLPTES)的定制兔多克隆抗体的特异性和有效性,作者进行了免疫荧光和蛋白质印迹分析。
免疫荧光分析(图5A)发现rtSPIRE1主要定位于细胞质,且定制抗体与Flag抗体染色模式一致,验证了其识别特异性。Western blot实验(图5B-C)证实该抗体能有效检测过表达和内源性rtSPIRE1,显示高灵敏度和特异性。对8对前列腺癌组织的分析(图5D)显示,rtSPIRE1在多数癌组织中表达上调。大样本免疫组化染色(100例患者,图5E)进一步证实rtSPIRE1在前列腺癌组织中显著高表达(图5F)。临床关联分析表明,rtSPIRE1表达与肿瘤分期正相关(图5G),且随Gleason评分升高表达逐渐增加(图5H-I)。生存分析显示,rtSPIRE1高表达患者无复发生存期和总生存期显著缩短(图5J),提示其作为独立预后标志物的潜力。这些结果综合表明,rtSPIRE1在前列腺癌中特异性高表达,与肿瘤恶性进展和不良预后紧密相关。

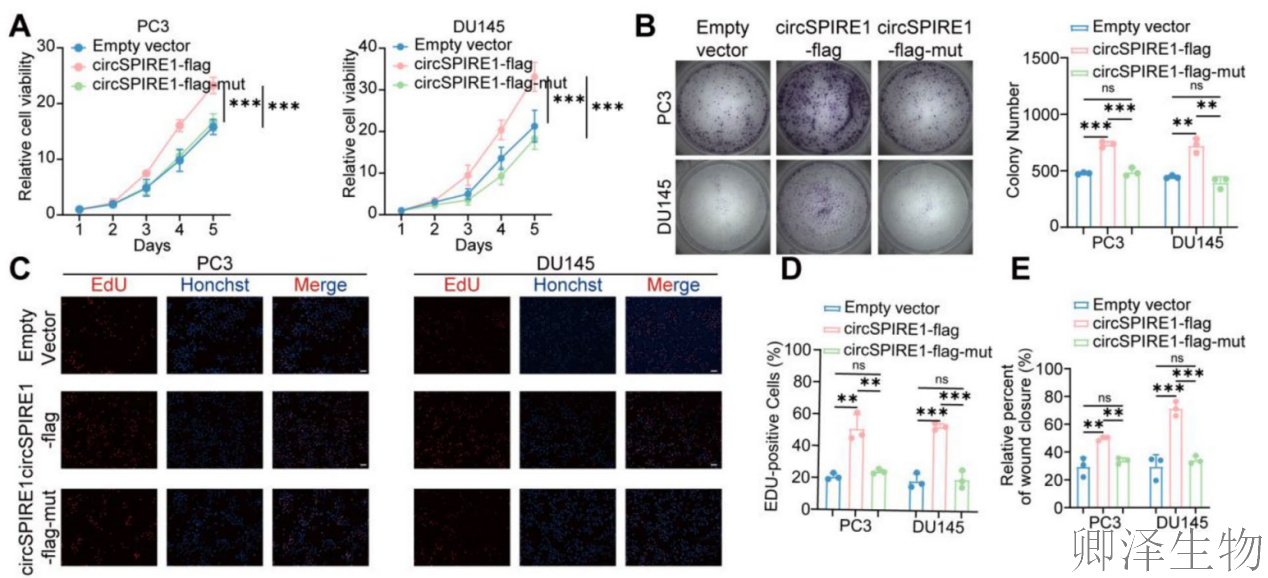
(6)新型蛋白rtSPIRE1促进前列腺癌的增殖和转移
为了进一步探究rtSPIRE1的生物学功能,作者进行了一系列功能实验,包括CCK8(图6A)、克隆形成(图6B)、EdU掺入(图6C-D)、伤口愈合(图6E-F)以及Transwell迁移和侵袭实验(图6G-H)。与空载体组和circSPIRE1-flag-mut组相比,circSPIRE1-flag组的增殖、侵袭和迁移能力显著增强。这些结果表明rtSPIRE1在促进肿瘤进展中起着关键作用。


体内实验中,皮下异种移植模型(图6I-K)证实rtSPIRE1编码组肿瘤体积和重量显著增加(n=6),表明其增强体内增殖能力;尾动脉注射骨转移模型(图6L)通过生物发光成像、X射线和H&E染色显示,rtSPIRE1组骨转移灶形成增加,统计分析(图6M)揭示骨转移率显著升高(n=8)。生存分析(图6N)表明rtSPIRE1组小鼠总生存期缩短。这些结果综合证明,rtSPIRE1通过促进细胞增殖、迁移、侵袭和体内转移,驱动前列腺癌进展和恶化。
(7)circSPIRE1激活PI3K/AKT信号通路,通过抑制LRP5的泛素化来稳定LRP5
接着,作者系统揭示了circSPIRE1通过稳定LRP5蛋白并激活PI3K/AKT信号通路促进前列腺癌进展的分子机制。

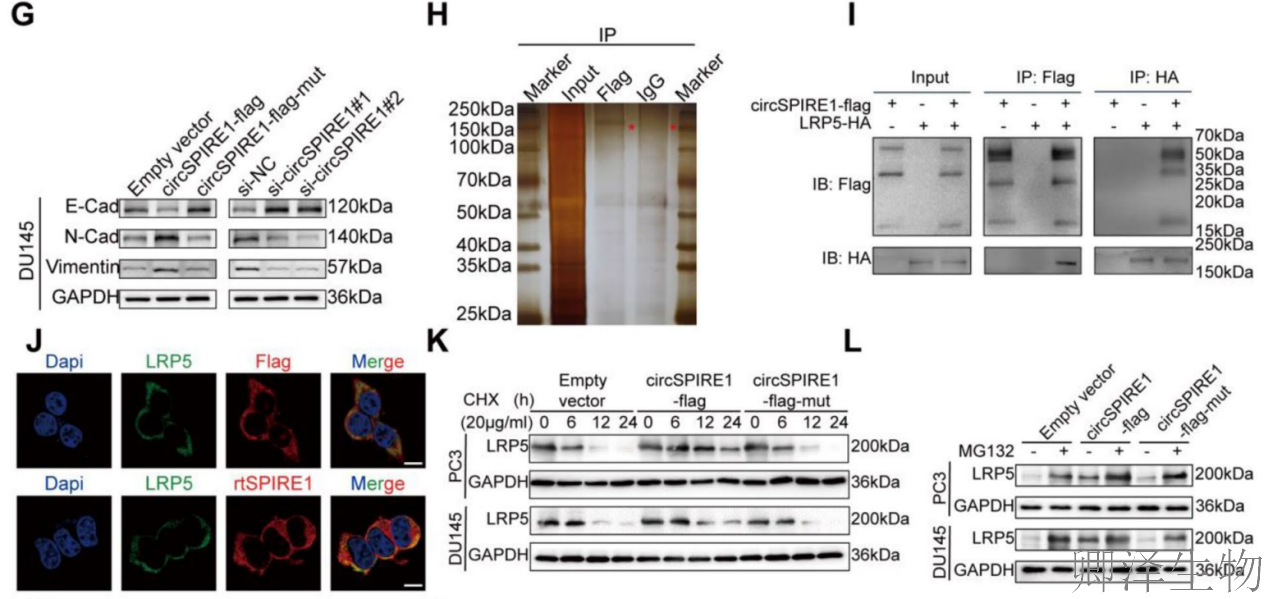
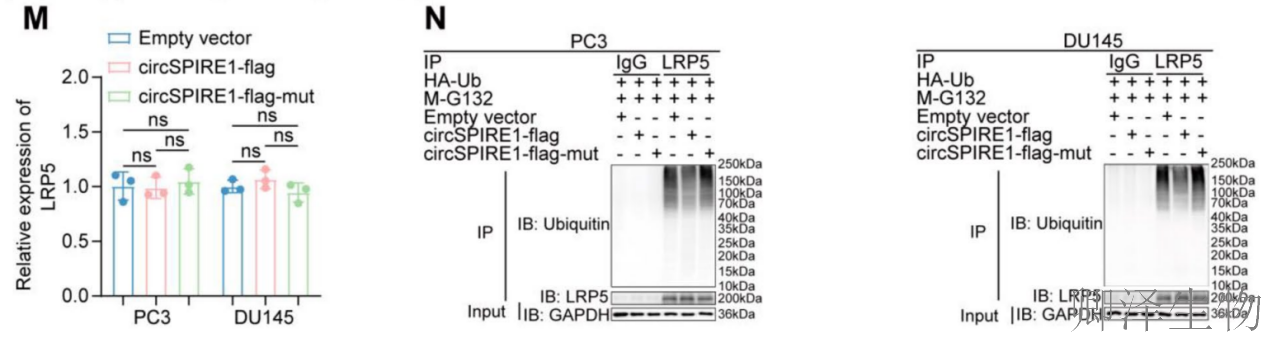
circSPIRE1通过抑制LRP5的泛素化降解,稳定LRP5蛋白,从而持续激活PI3K/AKT/mTOR信号通路,并诱导EMT,最终驱动前列腺癌增殖和转移。这一发现揭示了circRNA-蛋白相互作用在肿瘤信号传导中的新机制,为靶向LRP5-PI3K/AKT轴的治疗策略提供了理论基础。
(8)LRP5对于rtSPIRE1介导的增殖、迁移和PI3K/AKT激活至关重要
最后,作者采用系列功能验证实验证实了LRP5在rtSPIRE1介导的增殖、迁移中的作用(图8A-E)。Western blot分析提供了关键的分子机制,揭示出LRP5调控PI3K/AKT通路(图8F)。
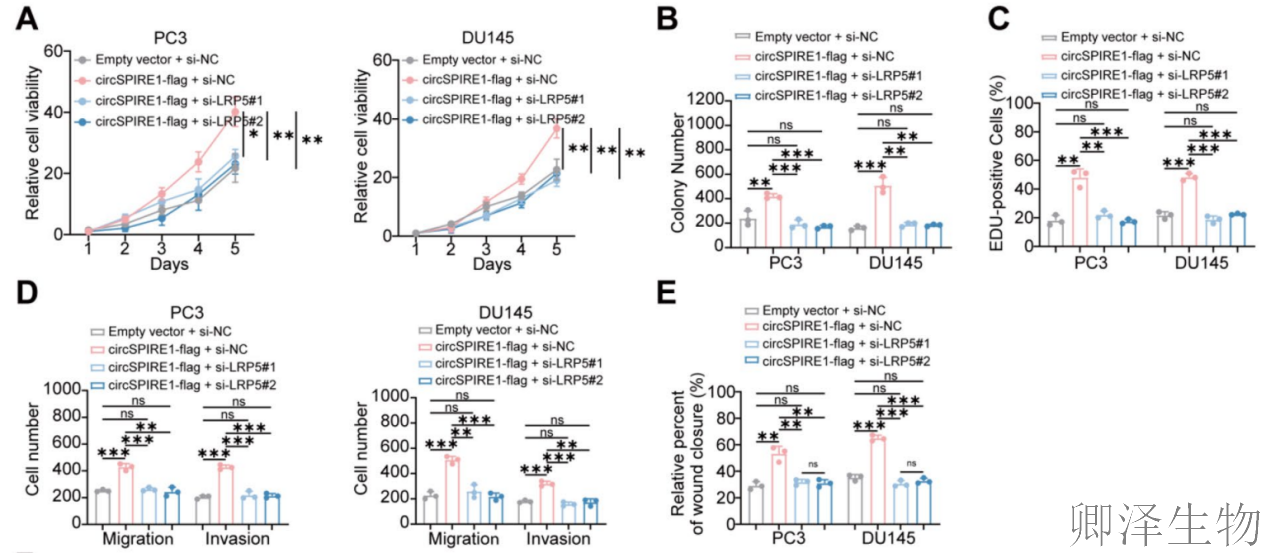
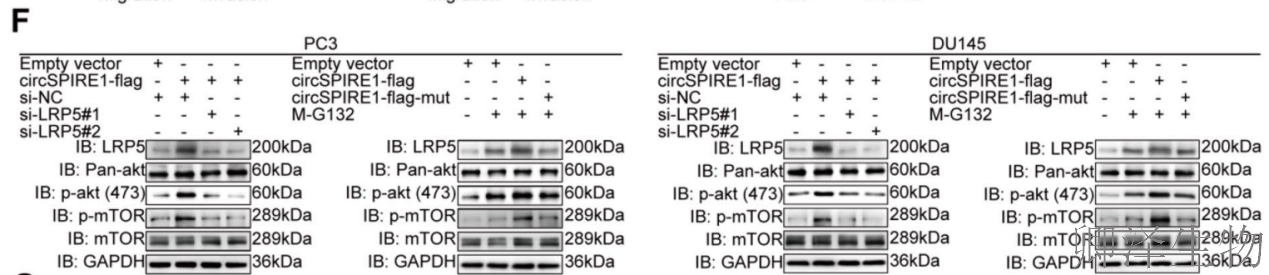
机制示意图(图8G)完整概括了本研究的核心发现:hnRNPA1通过其SDMA修饰促进circSPIRE1的IRES介导的滚动圈翻译,产生功能肽rtSPIRE1;rtSPIRE1通过与LRP5结合,抑制其泛素化降解,稳定LRP5蛋白水平;稳定的LRP5进而激活PI3K/AKT/mTOR信号通路,驱动前列腺癌细胞的增殖、迁移和侵袭,最终促进肿瘤进展。
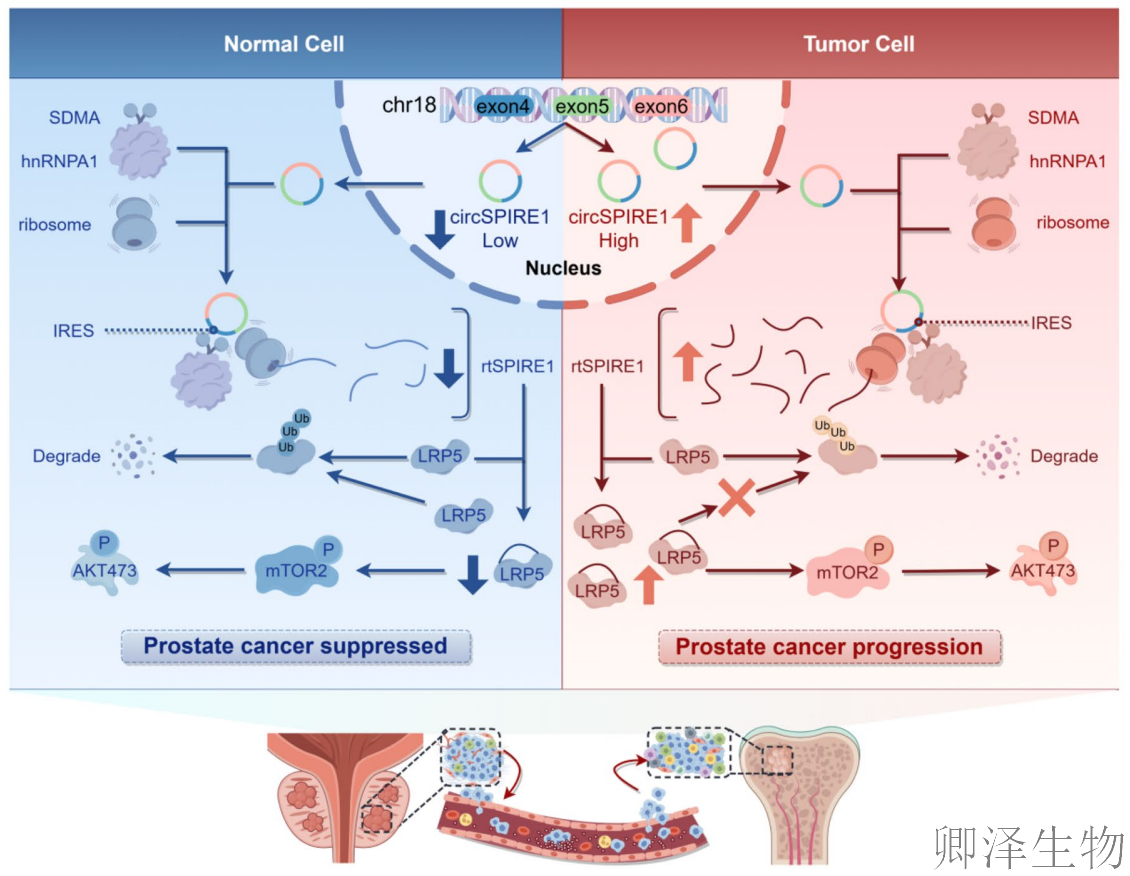
这些结果明确了LRP5是rtSPIRE1下游信号传导的关键效应器,为开发针对该通路的前列腺癌治疗策略提供了新的靶点。
研究结论
这项研究表明,hnRNPA1调控IRES驱动的circSPIRE1滚动环翻译,产生功能肽rtSPIRE1。通过稳定LRP5,rtSPIRE1激活PI3K/AKT信号通路,从而促进前列腺癌的进展。这些发现突出了靶向环状RNA编码肽治疗前列腺癌的治疗潜力。
circSPIRE1/rtSPIRE1——前列腺癌的新调控轴
欢迎致电了解详情或咨询!
广州卿泽生物科技有限公司
地址:广州市黄埔区伴河路96号一栋三层321房
电话:18925086102(微信同号)




